Page 136 - 第10期
P. 136
第41卷第10期
·1554 · 南 京 医 科 大 学 学 报 2021年10月
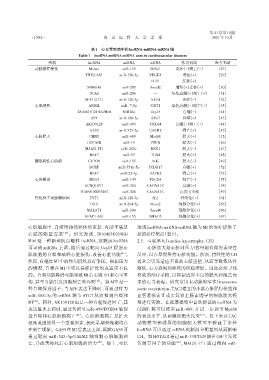
表1 心血管疾病中的lncRNA⁃miRNA⁃mRNA轴
Table 1 lncRNA⁃miRNA⁃mRNA axes in cardiovascular diseases
疾病 lncRNA miRNA mRNA 作用机制 参考文献
动脉粥样硬化 Malat1 miR⁃155 SOSC1 炎症(-)凋亡(-) [27]
TNK2⁃AS1 miR⁃150⁃5p VEGFA 增殖(+) [29]
FGF1 迁移(+)
SNHG16 miR⁃205 Smad2 增殖(+)迁移(+) [30]
UCA1 miR⁃206 — 氧化应激(+)凋亡(+) [31]
AF131217.1 miR⁃128⁃3p KLF4 炎症(-) [32]
心肌梗死 ANRIL miR⁃ 7⁃5p SIRT1 氧化应激(-)凋亡(-) [35]
2810403D21Rik/Mirf MiR26a Usp15 自噬(-) [41]
APF miR⁃188⁃3p ATG7 自噬(+) [43]
AK139128 miR⁃499 FOXO4 自噬(+)凋亡(+) [44]
GAS5 miR⁃525⁃5p CALM2 凋亡(+) [45]
心脏肥大 CHRF miR⁃489 Myd88 肥大(+) [15]
HOTAIR miR⁃19 PTEN 肥大(-) [46]
MAGI1⁃IT1 miR⁃302e DKK1 肥大(-) [47]
MIAT miR⁃93 TLR4 肥大(+) [48]
糖尿病性心肌病 CYTOR miR⁃155 IKKi 肥大(-) [49]
DCRF miR⁃551b⁃5p PCDH17 自噬(+) [52]
MIAT miR⁃22⁃3p DAPK2 凋亡(+) [53]
心房颤动 MEG3 miR⁃145 PDCD4 凋亡(-) [55]
KCNQ1OT1 miR⁃384 CACNA1C 房颤(+) [58]
TCONS 00075467 miR⁃328 CACNA1C 心房电重构 [59]
钙化性主动脉瓣疾病 PVT1 miR⁃128⁃3p Sp1 纤维化(+) [61]
TUG1 miR⁃204⁃5p Runx2 细胞分化(+) [65]
MALAT1 miR⁃204 Smad4 细胞分化(+) [66]
AFAP1⁃AS1 miR⁃155 SMAD5 细胞分化(+) [67]
心肌细胞中,自噬维持线粒体的更新,有助于满足 发现 lncRNA⁃miRNA⁃mRNA 轴为 MI 的治疗提供了
心脏的能量需求 [40] 。研究发现,2810403D21Rik/ 新的治疗靶点(表1)。
Mirf 是一种新型抗自噬性 lncRNA,沉默该 lncRNA 2.3 心脏肥大(cardiac hypertrophy,CH)
可导致 miR26a 上调,随后通过靶向 Usp15 促进心 心脏肥大是心脏对压力/容量超负荷的适应性
肌细胞的自噬和减轻心脏损伤,改善心脏功能 [41] 。 反应,以在早期维持心脏功能。然而,持续性的CH
然而,自噬在MI中的作用仍然具有争议。根据压力 通常会引发适应不良的心脏重塑,从而导致依从性
的情况,自噬在 MI 中可以是保护性的或适应不良 降低、心力衰竭和猝死的风险增加。因此必须寻找
的。自噬功能障碍可能导致MI后心肌I/R和心室重 有效的治疗手段,以抑制适应不良的肥大和随之而
构,甚至可能引发细胞凋亡和坏死 [42] 。如APF是一 来的心力衰竭。研究常用主动脉缩窄术(transverse
种自噬促进因子,当 APF 表达下降时,可通过作为 aortic constriction,TAC)建立的小鼠心脏肥厚模型和
miR⁃188⁃3p 的 ceRNA 调节 ATG7 从而抑制自噬和 血管紧张素Ⅱ或去氧肾上腺素诱导的细胞肥大模
[43]
MI 。同样,AK139128也是一种自噬促进因子,其 型进行实验。在肥厚模型中首次验证的 lncRNA 为
表达显著上调时,通过负调节miR⁃499/FOXO4 轴促 CHRF,其可以靶向 miR⁃489,并进一步调节 Myd88
进自噬和心肌细胞凋亡 [44] 。心肌细胞凋亡是扩大 的表达水平,从而激活肥大反应 [15] 。接下来在TAC
梗死范围的另一个重要因素,梗死早期和晚期均存 动物模型和诱导的细胞肥大模型中验证了多种
在凋亡现象。GAS5在MI后表达上调,沉默GAS5可 lncRNA 可以通过 ceRNA 机制调节靶基因从而影响
通过靶向 miR⁃525⁃5p/CALM2 轴抑制心肌细胞凋 CH。如HOTAIR通过miR⁃19/PTEN轴在CH中发挥
亡,并改善梗死后心肌细胞的活力 [45] 。综上,可以 负调节因子的功能 [46] ,MAGI1⁃IT1 通过靶向 miR⁃