Page 60 - 南京医科大学学报自然科学版
P. 60
第41卷第8期
·1162 · 南 京 医 科 大 学 学 报 2021年8月
胶(基质胶与无血清培养稀释比例为 1∶7),每孔 1.3 统计学方法
100 μL,30 min 后吸掉基质胶。将 HSF 用 DMEM 制 数据分析采用SPSS 13.0统计软件,定量资料以
成无血清悬液,在上室层各加入 250 μL,细胞数为 均数±标准差(x ± s)表示,采用t 检验或方差分析进
1.5×10 个/孔。下室加入10% FBS的DMEM,常规培 行组间比较,P < 0.05为差异有统计学意义。
4
养24 h。擦净上室面细胞,用4%的多聚甲醛固定下
2 结 果
室面剩余细胞,Giemsa 染色,统计细胞个数,以每个
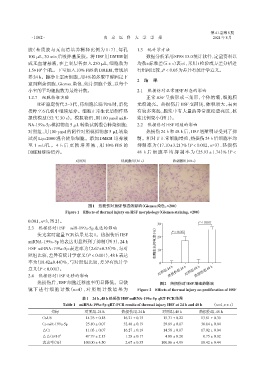
小室的平均细胞数为最终计数。 2.1 热损伤对正常HSF形态的影响
1.2.7 细胞转染实验 正常 HSF 呈梭形或三角形,个体饱满,细胞膜
HSF稳定传代2~3代,待细胞长满70%时,消化 光滑透亮。热损伤后 HSF 变圆钝,体积增大,表面
接种至6孔板中继续培养。细胞正常生长后制作热 有较多突起,胞浆中有大量的异常疏松透亮区,核
损伤模型(52 ℃ 30 s)。模拟物组,用100 pmol miR⁃ 浆比例变小(图1)。
NA⁃199a⁃5p模拟物加5 μL 转染试剂混合转染细胞; 2.2 热损伤对HSF增殖的影响
对照组,用100 pmol的阴性对照模拟物加5 μL转染 热损伤 24 h 和 48 h 后,HSF 增殖明显受到了抑
试剂 Lipo2000 混合转染细胞。添加 DMEM 培养液 制。相对于正常细胞增殖,热损伤24 h后细胞平均
至 1 mL/孔 。 4 h 后 更 换 培 养 液 ,用 10% FBS 的 抑制率为(17.10±3.21)%(P<0.002,n=3)、热损伤
DMEM继续培养。 48 h 后 细 胞 平 均 抑 制 率 为(25.93 ± 1.74)%(P<
对照组 热刺激组(30 s) 热刺激组(60 s)
图1 热损伤对HSF形态的影响(Giemsa染色,×200)
Figure 1 Effects of thermal injury on HSF morphology(Giemsa staining,×200)
0.001,n=3,图2)。 P<0.001
30
2.3 热损伤对HSF miR⁃199a⁃5p表达的影响 ( % ) P<0.002
荧光实时定量PCR结果见表1。热损伤后HSF 20
miRNA⁃199a⁃5p的表达明显得到了抑制(图3),24 h
HSF miRNA⁃199a⁃5p 表达率为(2.67±0.35)%,与对 细胞生长抑制率 10
照组比较,差异有统计学意义(P<0.001),48 h表达
率为(18.42±0.44)%,与对照组比较,差异有统计学 0
热损伤组24 h
热损伤组48 h
意义(P<0.001)。 对照组24 h 对照组48 h
2.4 热损伤对HSF迁移的影响
热损伤后,HSF 细胞迁移速率明显降低。显微 图2 热损伤对HSF增殖的影响
镜 下 进 行 细 胞 计 数(n=4),对 照 组 计 数 结 果 为 Figure 2 Effects of thermal injury on proliferation of HSF
表1 24 h、48 h热损伤HSF miRNA⁃199a⁃5p qRT⁃PCR结果
Table 1 miRNA⁃199a⁃5p qRT⁃PCR results of thermal injury HSF at 24 h and 48 h (n=4,x ± s)
指标 对照组⁃24 h 热损伤组⁃24 h 对照组⁃48 h 热损伤组⁃48 h
Ct⁃U6 14.76 ± 0.18 16.21 ± 0.15 15.31 ± 0.22 13.81 ± 0.30
Ct⁃miR⁃199a⁃5p 25.80 ± 0.07 32.48 ± 0.19 29.89 ± 0.07 30.84 ± 0.04
△Ct 11.03 ± 0.07 16.27 ± 0.19 14.58 ± 0.07 17.02 ± 0.04
5
△△Ct×10 47.79 ± 2.15 01.28 ± 0.17 4.08 ± 0.20 00.75 ± 0.02
表达率(%) 100.00 ± 4.50 02.67 ± 0.35 100.06 ± 4.99 18.42 ± 0.44