Page 26 - 南京医科大学学报自然科学版
P. 26
第42卷第6期
·778 · 南 京 医 科 大 学 学 报 2022年6月
Lig
心肌梗死/氧糖剥夺
心肌梗死/氧糖剥夺+Lig
活性氧释放
细胞凋亡
自噬体 溶酶体 自噬溶酶体
活性氧释
放增多 线粒体碎片
化细胞凋亡
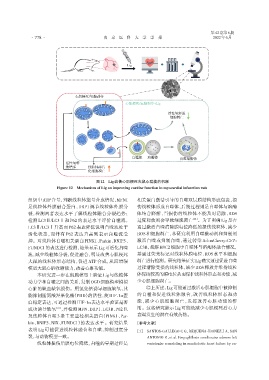
图12 Lig改善心肌梗死大鼠心功能的机制
Figure 12 Mechanism of Lig on improving cardiac function in myocardial infarction rats
组织中ATP含量,判断线粒体能量合成情况,MFN1 相关蛋白激活引导的自噬双层膜结构形成包裹,损
是线粒体外膜融合蛋白,DRP1 调节线粒体外膜分 伤线粒体形成自噬体,后期过程则是自噬体与溶酶
裂,检测两者表达水平了解线粒体融合分裂趋势; 体结合降解,当损伤的线粒体不能及时清除,ROS
检测 LC3Ⅱ/LC3Ⅰ和 P62 的表达水平评价自噬流, 过度释放则会导致细胞凋亡 [22] 。为了明确Lig是否
LC3Ⅱ/LC3Ⅰ升高而 P62 表达降低说明自噬流处于 通过激活自噬清除膜电位降低的损伤线粒体,减少
活化状态,而伴有 P62 表达升高则表示自噬流受 ROS 和细胞凋亡,本研究利用自噬激动剂和抑制剂
抑。对线粒体自噬相关蛋白PINK1、Parkin、BNIP3、 激活自噬或抑制自噬,通过转染 Ad⁃mCherry⁃GFP⁃
FUNDC1的表达进行检测,结果显示Lig可活化自噬 LC3B,观察H9C2细胞中自噬体与溶酶体融合情况,
流,减少线粒体分裂,促进融合,明显改善心肌梗死 并通过荧光标记对线粒体膜电位、ROS 水平和细胞
大鼠的线粒体形态结构,促进 ATP 合成,从而增强 凋亡进行检测。研究结果证实Lig确实通过促进自噬
模型大鼠心脏收缩能力,改善心脏功能。 过程清除受损的线粒体,减少ROS释放并维持线粒
本研究进一步在细胞模型上验证Lig 与线粒体 体保持较高的膜电位从而保护线粒体形态和功能,减
动力学和自噬之间的关系,复制OGD细胞模型模拟 少心肌细胞凋亡。
心脏的缺血缺氧损伤。用氯化钴诱导细胞缺氧,其 综上所述,Lig可能通过激活心肌细胞中被抑制
能抑制脯氨酸羟基化酶(PHD)的活性,使HIF⁃1α蛋 的自噬和促进线粒体融合,改善线粒体形态和功
白稳定表达,可通过检测HIF⁃1α表达水平验证是否 能,减少心肌细胞凋亡,发挥改善心脏功能的作
成功诱导缺氧 [21] ,并检测 MFN、DRP1、LC3B、P62 以 用。这些研究提示Lig可能是减少心肌梗死后心力
衰竭发生的潜在有效药物。
及线粒体自噬 3 条主要途径相关蛋白(PINK1、Par⁃
kin、BNIP3、NIX、FUNDC1)的表达水平。研究结果 [参考文献]
表明 Lig 可能促进线粒体融合和自噬,抑制过度分
[1] SANTOS⁃GALLEGO C G,REQUENA⁃IBANEZ J A,SAN
裂,与动物模型一致。 ANTONIO R,et al. Empagliflozin ameliorates adverse left
线粒体损伤后膜电位降低,自噬的早期过程是 ventricular remodeling in nondiabetic heart failure by en⁃