Page 30 - 南京医科大学学报自然科学版
P. 30
第42卷第6期
·782 · 南 京 医 科 大 学 学 报 2022年6月
(1∶50)、多克隆兔抗 GFAP 抗体(1∶500)、多克隆兔 1.3 统计学方法
抗 Iba⁃1 抗体(1∶100)、单克隆大鼠抗 CD31 抗体(1∶ 使用 GraphPad Prism 6.0 软件进行分析。各组
100)、单克隆小鼠抗Bmi⁃1抗体(1∶500),4 ℃孵育过 数据以均数±标准差(x ± s)表示。采用单因素方差
夜;加相应二抗,Alex Fluor 594 标记驴抗小鼠 IgG、 分析(one⁃way ANOVA)进行多组间数据比较,采用
Alex Fluor 488 标记驴抗大鼠 IgG、Alex Fluor 488 标 SNK 法对多组间数据进行两两比较,P < 0.05 为差
记驴抗兔 IgG(1∶1 000),37 ℃孵育 1 h;DAPI(1∶1 异有统计学意义。
000)孵育10 min,甘油封片后于Leica正置荧光显微
2 结 果
镜观察摄片。使用 Image⁃Pro Plus 5.0.1 软件分析
Bmi⁃1 与 Iba⁃1、CD31、NeuN 与 GFAP 双阳性细胞百 2.1 SCI后小鼠脊髓组织病理学变化
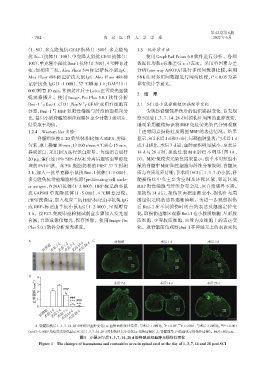
分率,Bmi⁃1 与 MBP 双阳性细胞与纤维的面积百分 为观察脊髓钝挫伤后的组织缺损变化,首先观
比,每只小鼠脊髓的相应观察区至少计数3张切片, 察SCI后1、3、7、14、28 d时损伤灶周围的血肿改变,
结果取平均值。 继而采用髓鞘标识物 MBP 免疫荧光染色分别观察
1.2.4 Western blot实验 上述时间点损伤灶及周围 MBP 的表达情况。结果
脊髓组织按1∶20质量/体积比加入RIPA,剪碎、 显示,SCI术后1 d和3 d时,局部血肿显著;与术后1 d
匀浆,冰上静置30 min,13 000 r/min 4 ℃离心15 min, 或3 d相比,术后7 d起,血肿面积明显减小;至术后
提取蛋白,采用BCA法行蛋白定量。每组蛋白加样 14 d 与 28 d 时,损伤灶表面血肿已不明显(图 1A、
20 μg,蛋白经10% SDS⁃PAGE分离后湿转至甲醇处 B)。MBP免疫荧光染色结果显示:假手术对照组小
理的 PVDF 膜。含 5% 脱脂奶粉的 PBST 37 ℃封闭 鼠的脊髓中MBP阳性细胞与纤维分布规则,脊髓灰
2 h,加入一抗单克隆小鼠抗 Bmi⁃1 抗体(1∶1 000)、 质与白质境界清晰;手术组(SCI后1、3、7 d)小鼠,脊
多克隆兔抗增殖细胞核抗原(proliferating cell nucle⁃ 髓损伤灶中央主要为空洞及坏死区域、邻近区域
ar antigen,PCNA)抗体(1∶2 000)、HRP 标记的小鼠 MBP 阳性细胞与纤维分布杂乱,灰白质境界不清。
抗 GAPDH 单克隆抗体(1∶5 000),4 ℃孵育过夜。 至损伤 14 d 后,损伤区面积逐渐变小,损伤灶与周
PBST洗涤后,加入相应二抗HRP⁃标记山羊抗兔IgG 围组织之间的边界逐渐清晰。为进一步观察损伤
或 HRP⁃标记山羊抗小鼠 IgG(1∶2 000),室温孵育 后 Bmi⁃1 在不同损伤时间点的表达及细胞定位变
1 h。按 ECL 免疫印迹检测试剂盒步骤加入发光混 化,取损伤边缘区观察Bmi⁃1在小胶质细胞、星形胶
合液,自动成像仪曝光,保存图像。使用 Image⁃Pro 质细胞、少突胶质细胞、血管内皮细胞上的表达变
Plus 5.0.1软件分析发光强度。 化。取脊髓前角观察Bmi⁃1在神经元上的表达变化
A C 对照组 术后1 d 术后3 d
术后28 d
对照组 术后1 d 术后3 d 术后7 d 术后14 d
B
( mm 2 ) 4 3 ### 术后7 d 术后14 d 术后28 d
血肿面积 2 1 * ###
*** ###
***
0
对照组 术后1 d 术后3 d 术后7 d 术后28 d
术后14 d
*
***
###
A:脊髓损伤后1、3、7、14、28 d时组织血肿变化;B:血肿面积统计结果,与术后1 d相比,P < 0.05, P < 0.001,与术后3 d相比, P < 0.001
(n=6);C:MBP免疫荧光染色显示SCI后1、3、7、14、28 d时损伤灶大小变化(a:损伤边缘区,b:脊髓前角,白色虚线示损伤灶边缘)。标尺=500 μm。
图1 小鼠SCI后1、3、7、14、28 d的脊髓组织血肿与损伤灶变化
Figure 1 The changes of haematoma and contusitive area in spinal cord at the day of 1,3,7,14 and 28 post SCI