Page 109 - 南京医科大学自然版
P. 109
第44卷第4期 胡永灿,吕 凌. 腺嘌呤核苷酸转位酶:生理功能及在疾病发生中的病理意义[J].
2024年4月 南京医科大学学报(自然科学版),2024,44(04):546-552,566 ·547 ·
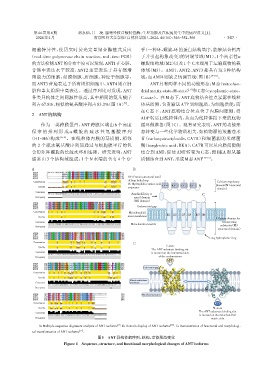
细胞特异性,使用实时荧光定量聚合酶链式反应 手(一种环⁃螺旋⁃环的蛋白结构基序,能够结合钙离
(real⁃time polymerase chain reaction,real⁃time PCR) 子并引起构象改变)的钙调节域(M1)、1个两亲性α
的方法检测ANT的分布丰度可以发现,ANT1在心脏、 螺旋结构域(M2)以及1个C末端用于运输底物的载
骨骼中表达水平较高,ANT2 主要表达于具有强增 体域(M3)。ANT1、ANT2、ANT3 都具有这 3 种结构
[9-10]
殖能力的细胞,如癌细胞、肝细胞、神经干细胞等, 域,而ANT4则缺乏钙调节域(图1B) 。
而ANT3普遍表达于所有组织细胞中,ANT4则在肝 ANT具有两种不同的功能形态:M态(mitochon⁃
[11]
脏和睾丸组织中高表达。通过序列比对发现,ANT drial matrix⁃state,M⁃state) 和C态(cytoplasmic⁃state,
各类异构体之间同源性很高,其中相同的氨基酸序 C⁃state)。在M态下,ANT底物结合位点暴露在线粒
[7]
列占67.8%,相似的氨基酸序列占83.2%(图1A) 。 体基质侧,负责输送ATP到细胞质,为细胞供能;而
在 C 态下,ANT 底物结合位点位于内膜间隙侧,将
2 ANT的结构
ADP转运回线粒体内,从而为线粒体接下来的底物
作为一类跨膜蛋白,ANT 跨膜区域由 6 个高度 循环做准备(图1C)。现有研究表明,ANT的功能形
保 守 的 排 列 形 成 α 螺 旋 的 疏 水 性 氨 基 酸 序 列 态转变与一些化学物质相关,如植物源的羧基苍术
(H1~H6)构成 [6,8] 。在线粒体内膜的基质侧,相邻 苷(carboxyatractyloside,CATR)和细菌源的米酵菌
的 2 个疏水氨基酸序列间通过与细胞膜平行的包 酸(bongkrekic acid,BKA),CATR可以从内膜间隙侧
含短矩阵螺旋的长疏水环相连接。研究表明,ANT 结合到 ANT,促使 ANT 转变为 C 态,而 BKA 则从基
[12-13]
通常由 3 个结构域组成:1 个 N 末端的含有 4 个 EF 质侧结合到ANT,形成M态ANT 。
A B
ANT4 1 67
ANT1 1 54
ANT2 1 45 EF:Protein structural motif
ANT3 1 54
of loop helix loop
Conservation Calcium regulatory
H:Hydrophobic amino acid domain(M1 structural
Quality sequence EF⁃4 EF⁃3 EF⁃2 EF⁃1 N domain)
Consensus
Amphiphilicity α C
Occupancy spiral domain
(M2 domain)
ANT4 68 134
ANT1 55 121
ANT2 55 121 Endometrial gap
ANT3 55 121
Conservation Mitochondrial
H1 H2 H3 H4 H5 H6
Quality inner membrane
Carrier domain for
Consensus transporting
Mitochondrial matrix substrates(M3
Occupancy
structural domain)
ANT4 135 201
ANT1 122 188
ANT2 122 188 Long hydrophobic ring
ANT3 122 188
Conservation
C
C⁃state
Quality
The ANT substrate binding site
Consensus
is located on the interstitial side
Occupancy of the endometrium
ADP
ANT4 202 266
ANT1 189 255
ANT2 189 255 Endometrialgap
ANT3 189 255
Conservation
Quality
Mitochondrialinner
Consensus membrane
Occupancy
ANT4 267 320 Mitochondrialmatrix
ANT1 256 298
ANT2 256 298
ANT3 256 298
Conservation ATP
Quality M⁃state
The ANT substrate binding site
Consensus
is located on the mitochondrial
Occupancy matrix side
[7] [10]
A:Multiple sequence alignment analysis of ANT isoforms . B:Domain display of ANT isoforms . C:Demonstration of functional and morphologi⁃
[11]
cal transformation of ANT isoforms .
图1 ANT异构体的序列、结构、功能形态变化
Figure 1 Sequence,structure,and functional morphological changes of ANT isoforms