Page 48 - 南京医科大学学报自然科学版
P. 48
第43卷第3期
·338 · 南 京 医 科 大 学 学 报 2023年3月
胞的红色荧光,表明所选的实验浓度对细胞无毒性 A 3.0
(图3)。 2.5
*
2.4 BP对hDPSC的ALP活性的影响 nm ) 2.0
ALP 染色评价 BP 对 hDPSC 成骨分化早期 ALP ( 450 1.5 *
表达的影响。结果表明,在7 d成骨诱导后,BP组与 D 1.0
*
对照组均有 ALP 的深蓝色着色团块且 BP 组染色较 0.5
深(图 4 A)。ALP 活性定量结果显示,BP 组 ALP 活 0
240.0 μmol/L BP组
对照组
15.0 μmol/L BP组
120.0 μmol/L BP组
30.0 μmol/L BP组
性高于对照组(图4 B,P < 0.01)。15.0 μmol/L BP组 7.5μmol/L BP组 60.0 μmol/L BP组
ALP 活力较7.5 μmol/L BP 组与30.0 μmol/L BP 组稍
B
高,差异有统计学意义(图4B,P < 0.01)。 3 对照组
2.5 BP对hDPSC细胞外基质矿化的影响 7.5 μmol/L BP组
15.0 μmol/L BP组
ARS 染色检测细胞外基质钙结节来评价 BP 对 2 30.0 μmol/L BP组
hDPSC 成骨分化晚期外基质矿化的影响。结果表 ( 450 nm )
明,在 21 d 连续成骨诱导后,BP 组与对照组均显示 D 1
矿化物沉积,BP 组结节数目多于对照组,且染色较
0
深,其中 15.0 μmol/L BP 组染色较 7.5 μmol/L BP 组 0 1 2 3 4 5 6 7 8
时间(d)
与 30.0 μmol/L BP 组更深(图 5 A)。ARS 半定量结
*
A:细胞毒性检测;B:生物安全性检测。与对照组相比,P <
果与染色结果相符(图5B,P < 0.01)。
0.01(n=3)。
2.6 BP对hDPSC成骨相关基因表达的影响 图2 细胞毒性及生物安全性检测
qRT⁃PCR 分析探究 BP 对 hDPSC 成骨基因表达 Figure 2 Cytotoxicity and biosafety detection
对照组 7.5 μmol/L BP组 15.0 μmol/L BP组 30.0 μmol/L BP组
图3 活死细胞荧光染色(×100)
Figure 3 Cell live/dead fluorescence staining(×100)
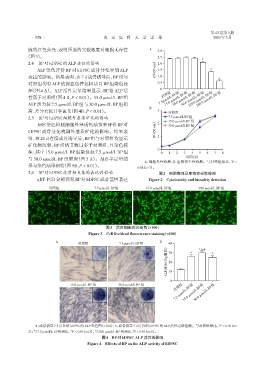
A 对照组 7.5 μmol/L BP组 B 40
( U/g蛋白 ) 30 * *△# *
20
ALP活性 10
0
15.0 μmol/L BP组
7.5 μmol/L BP组 30.0 μmol/L BP组
15.0 μmol/L BP组 30.0 μmol/L BP组 对照组
*
A:成骨诱导 7 d 后各组 hDPSC 的 ALP 染色图(×100);B:成骨诱导 7 d 后各组 hDPSC 的 ALP 活性定量检测。与对照组相比,P < 0.01(n=
3);与7.5 μmol/L BP组相比,P < 0.01(n=3);与30.0 μmol/L BP组相比,P < 0.01(n=3)。
△
#
图4 BP对hDPSC ALP 活性的影响
Figure 4 Effects of BP on the ALP activity of hDPSC