Page 133 - 南京医科大学学报自然科学版
P. 133
第43卷第4期 朱睿放,张 宇,卢应梅. 小胶质细胞及其介导的神经炎症在帕金森病中的作用[J].
2023年4月 南京医科大学学报(自然科学版),2023,43(04):569⁃576 ·571 ·
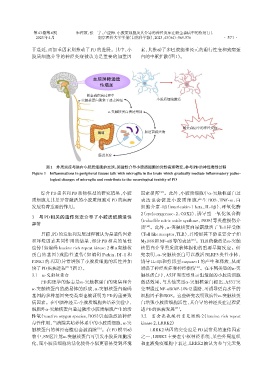
干蔓延,而加重因素则推动了PD的进展。其中,小 素,其推动了多巴胺能神经元的退行性变和致病蛋
胶质细胞介导的神经炎症被认为是重要的加重因 白的中枢扩散(图1)。
血脑屏障通透
性增加
帕金森疾病过程中
α⁃突触核蛋白聚集于迷走神经 小胶质细胞激活
α⁃突触核蛋白表达增加
帕金森病中的神经炎症
肠道菌群失衡
肠道炎症
图1 外周炎症与脑内小胶质细胞的交谈,渐进性介导小胶质细胞的炎性病理转变,参与PD的神经毒性过程
Figure 1 Inflammations in peripheral tissues talk with microglia in the brain which gradually mediate inflammatory patho⁃
logical changes of microglia and contribute to the neurological toxicity of PD
综合 PD 患者和 PD 动物模型的研究结果,小胶 因素损害 [23] 。此外,小胶质细胞中α⁃突触核蛋白过
质细胞尤其是异常激活的小胶质细胞对PD 的疾病 表达也会促进小胶质细胞产生 ROS、TNF⁃α、白
发展有着重要的作用。 细胞介素⁃1β(interleukin⁃1 beta,IL⁃1β)、环氧化酶
2(cyclooxygenase⁃2,COX2)、诱导型一氧化氮合酶
3 与 PD 相关的遗传突变介导了小胶质细胞活性
(inducible nitric oxide synthase,iNOS)等炎性损伤介
异常
质 [24] 。此外,α⁃突触核蛋白暴露激活了 Toll 样受体
目前,PD的发生和发展过程被认为是遗传因素 (Toll like receptor,TLR),并增加其下游重要分子如
和环境因素共同作用的结果,部分 PD 相关的显性 MyD88和NF⁃κB等的表达 [25] 。TLR的激活是α⁃突触
遗传(如编码 leucine rich repeat kinase 2 和α突触核 核蛋白介导黑质纹状体损伤的重要早期反应。研
蛋白的基因)或隐性遗传(如编码 Parkin、DJ⁃1 和 究表明,α⁃突触核蛋白可以激活 NLRP3 炎性小体,
PINK1 的基因)异常增强了小胶质细胞的活性并加 诱导 IL⁃1β和剪切型 caspase⁃1 的产生和释放,从而
[21]
快了PD疾病进程 (图2)。 增强了神经炎症和神经损伤 [26] 。在不同类型的α⁃突
3.1 α⁃突触核蛋白 触核蛋白中,A53T突变型显示出最强的小胶质细胞
PD 病理学的标志是α⁃突触核蛋白的聚集和含 激活效果,与其他类型α⁃突触核蛋白相比,A53T 突
α⁃突触核蛋白的路易体的形成,α⁃突触核蛋白编码 变型通过NF⁃κB/AP⁃1/Nrf2通路,可诱导更高水平的
基因的多种基因突变类型也被证明为PD 的重要致 细胞因子和ROS。这些研究表明致病性α⁃突触核蛋
病因素。在中脑神经元⁃小胶质细胞共培养实验中, 白增强小胶质细胞活性,其介导的神经炎症过程促
细胞外α⁃突触核蛋白通过激活小胶质细胞产生的活 进PD的疾病发展 。
[27]
性氧(reactive oxygen species,ROS)引起强烈的神经 3.2 富含亮氨酸的重复激酶 2(leucine rich repeat
毒性作用,当消除共培养体系中的小胶质细胞,α⁃突 kinase 2,LRRK2)
触核蛋白的神经毒性也会被消除 [22] 。在PD 模型动 LRRK2基因的突变也是PD最常见的遗传因素
物中,SN区注射α⁃突触核蛋白可引发小胶质细胞活 之一,LRRK2 主要在中枢神经系统、某些外周组织
化,而小胶质细胞的活化使得小鼠更容易受到环境 和血液免疫细胞中表达,LRRK2被认为参与先天免