Page 21 - 南京医科大学自然版
P. 21
第44卷第6期 张赟豪,韩博昂,王 瑜,等. SENP1在SPOP去SUMO化修饰中的作用研究[J].
2024年6月 南京医科大学学报(自然科学版),2024,44(6):753-761 ·757 ·
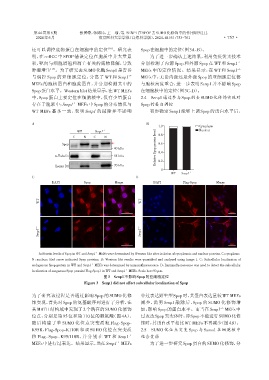
还可以调控底物蛋白在细胞中的定位 [18] 。研究表 Spop在细胞中的定位(图3A、B)。
明,在 ccRCC 中 SPOP 错误定位在胞质中并大量累 为了进一步确认上述结果,利用免疫荧光技术
积,靶向与细胞增殖和凋亡有关的底物降解,导致 分别检测了内源 Spop 和外源 Spop 在 WT 和 Senp1 -/-
肿瘤增生 [15] 。为了研究去SUMO 化酶Senp1是否参 MEFs 中的定位情况。结果显示,在 WT 和 Senp1 -/-
与调控 Spop 的亚细胞定位,分离了 WT 和 Senp1 -/- MEFs 中,无论内源还是外源 Spop 的亚细胞定位都
MEFs 的胞核蛋白和胞浆蛋白,并分别检测其中的 与胞核高度重合,进一步表明 Senp1 并不影响 Spop
Spop蛋白水平。Western blot结果显示,在WT MEFs 在细胞核中的定位(图3C、D)。
中,Spop 蛋白主要定位在细胞核中,仅有少量蛋白 2.4 Senp1通过参与Spop的去SUMO化修饰实现对
存在于胞浆中;Senp1 MEFs 中 Spop 的分布情况与 Spop的蛋白调控
-/-
WT MEFs 基本一致,表明 Senp1 的敲除并不影响 初步确定 Senp1 能够上调 Spop 的蛋白水平后,
A B
1.0 Cytoplasm
Relative Spop protein level
WT Senp1 -/- Nuclear
C N C N 0.8
Spop 0.6
- 40 kDa
α⁃Tubulin - 55 kDa 0.4
0.2
Lamin B1 - 70 kDa
0
WT Senp1 -/-
C D
DAPI Spop Merge DAPI Flag⁃Spop Merge
WT WT
Senp1 -/- Senp1 -/-
A:Protein levels of Spop in WT and Senp1 MEFs were determined by Western blot after isolation of cytoplasmic and nuclear proteins. C:cytoplasm;
-/-
N:nuclear;Red arrow indicated Spop proteins. B:Western blot results were quantified and analyzed using Image J. C:Subcellular localization of
-/-
endogenous Spop protein in WT and Senp1 MEFs was determined by immunofluorescence. D:Immunofluorescence was used to detect the subcellular
-/-
localization of exogenous Spop protein(Flag⁃Spop)in WT and Senp1 MEFs. Scale bar=50 μm.
图3 Senp1不影响Spop的亚细胞定位
Figure 3 Senp1 did not affect subcellular localization of Spop
为了研究该过程是否通过影响 Spop 的 SUMO 化修 中过表达野生型Spop时,其蛋白表达量较WT MEFs
饰实现,首先对 Spop 的氨基酸序列进行了分析,在 减少,说明 Senp1 敲除后,Spop 的 SUMO 化修饰增
其MATH结构域中发现了2个潜在的SUMO化修饰 加,影响Spop 的蛋白水平。而当在Senp1 MEFs 中
-/-
位点,分别是第 95 位和第 110 位的赖氨酸(图 4A)。 过表达Spop突变体时,即Spop不能进行SUMO化修
随后构建了单 SUMO 化位点突变质粒 Flag⁃Spop⁃ 饰时,其蛋白水平相比WT MEFs不再减少(图4B)。
K95R、Flag⁃Spop⁃K110R 和双 SUMO 化位点突变质 2.5 SUMO 化位点突变 Spop 与 Sumo1 在细胞核中
粒 Flag ⁃ Spop ⁃ K95/110R,并 分 别 在 WT 和 Senp1 -/- 结合变弱
-/-
MEFs中进行过表达。结果显示,当在Senp1 MEFs 为了进一步研究Spop 蛋白的SUMO 化修饰,分