Page 22 - 南京医科大学自然版
P. 22
第44卷第6期
·758 · 南 京 医 科 大 学 学 报 2024年6月
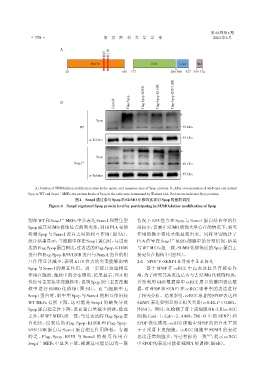
A
K95 K110
MATH BTB 3⁃box NLS
28 166 177 296 300 327 359 374
Control
B Flag⁃Spop Flag⁃Spop⁃K95R Flag⁃Spop⁃K110R Flag⁃Spop⁃K95/110R
Spop
WT - 40 kDa
- 55 kDa
α⁃Tubulin
Spop
Senp1 -/- - 40 kDa
- 55 kDa
α⁃Tubulin
A:Position of SUMOylation modification sites in the amino acid sequence map of Spop proteins. B:After overexpression of wild⁃type and mutant
-/-
Spop in WT and Senp1 MEFs,the protein levels of Spop in the cells were determined by Western blot. Red arrows indicated Spop proteins.
图4 Senp1通过参与Spop的SUMO化修饰实现对Spop的蛋白调控
Figure 4 Senp1 regulated Spop protein level by participating in SUMOylation modification of Spop
别在 WT 和 Senp1 MEFs 中共表达 Sumo1 和野生型 情况下 K95 位点在 Spop 与 Sumo1 蛋白结合中的作
-/-
Spop 或其 SUMO 修饰位点的突变体,利用 PLA 实验 用较小,需要在SUMO修饰大量存在的情况下,相互
检测 Spop 与 Sumo1 蛋白之间的相互作用(图 5A)。 作用的微小变化才能显现出来。同样分别统计了
统计结果显示,当细胞中存在Senp1蛋白时,与过表 PLA 信号在 Senp1 MEFs 细胞中的分布情况,结果
-/-
达的Flag⁃Spop蛋白相比,过表达的Flag⁃Spop⁃K110R 与WT MEFs组一致,SUMO化修饰后的Spop蛋白主
蛋白和Flag⁃Spop⁃K95/110R蛋白与Sumo1蛋白的相 要定位在胞核中(图5C)。
互作用显著减少,表明 K110 位点的突变能够影响 2.6 SPOP和SENP1在肾癌中呈正相关
Spop 与 Sumo1 的相互作用。进一步统计这些相互 鉴于 SPOP 在 ccRCC 中高表达且具有核心作
作用在胞质、胞核中的分布情况,结果显示,PLA 阳 用,为了研究其高表达是否与去SUMO化修饰相关,
性信号主要集中在胞核中,说明Spop蛋白主要在胞 首先利用 GEO 数据库中 ccRCC 患者的基因表达数
核中进行 SUMO 化修饰(图 5B)。而当细胞中无 据,对 SPOP 和 SENP1 在 ccRCC 患者中的表达进行
Senp1 蛋白时,野生型 Spop 与 Sumo1 的相互作用较 了相关分析。结果表明,ccRCC患者的SPOP表达和
WT MEFs 有所下降,这可能是 Senp1 的缺失导致 SENP1表达呈明显的正相关关系(r=0.44,P < 0.001,
Spop 蛋白稳定性下降,进而蛋白量减少所致;除此 图6A)。同时,还检测了肾上皮细胞HK⁃2和ccRCC
之外,和WT MEFs 组一致,与过表达的Flag⁃Spop 蛋 细胞 Caki⁃1、Caki⁃2、A498、786⁃O 中的 SENP1 和
白相比,过表达的 Flag⁃Spop⁃K110R 和 Flag⁃Spop⁃ SPOP 表达情况,ccRCC 细胞中 SPOP 的蛋白水平高
K95/110R 蛋白与 Sumo1 蛋白相互作用降低。有趣 于正常肾上皮细胞。ccRCC 细胞中 SENP1 的表达
的 是 ,Flag ⁃ Spop ⁃ K95R 与 Sumo1 的 相 互 作 用 在 也比正常细胞多,与已有报道一致 [16] ,提示 ccRCC
Senp1 MEFs 中显著下降,推测这可能是因为一般 中SPOP的表达可能受SENP1的调控(图6B)。
-/-