Page 26 - 第10期
P. 26
第41卷第10期
·1444 · 南 京 医 科 大 学 学 报 2021年10月
A B C
4 5 3.5 *
* 4 * 3.0
Runx2 mRNA 相对表达量 2 mRNA 相对表达量 3 2 # mRNA 相对表达量 2.0 #
3
2.5
BMP2
1.5
Msx2
1.0
1
1
0.5
0 0 0
华法林处理组
华法林处理组
正常对照组 EGB761干预组 正常对照组 EGB761干预组 正常对照组 EGB761干预组
华法林处理组
D E 4 * * Runx2
EGB761干预组
正常对照组 华法林处理组 3 * Msx2
BMP2
Runx2 60 kDa 蛋白相对表达水平 2 # # #
Msx2 29 kDa 1
BMP2 44 kDa 0
华法林处理组
GAPDH 37 kDa 正常对照组 EGB761干预组
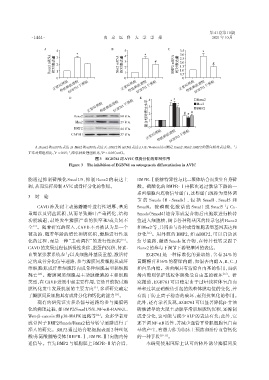
A:Runx2的mRNA表达;B:Msx2的mRNA表达;C:BMP2的mRNA表达;D、E:Western blot测定Runx2、Msx2、BMP2的蛋白相对表达量。与
正常对照组相比,P < 0.05;与华法林处理组相比,P < 0.05(n=6)。
#
*
图3 EGB761对AVIC成骨分化的抑制作用
Figure 3 The inhibition of EGB761 on osteogenesis differentiation in AVIC
能通过抑制磷酸化 Smad1/5,抑制 Runx2 的表达上 BMPR⁃Ⅰ能够特异性与此二聚体结合而发生自身磷
调,从而发挥抑制AVIC成骨样分化的作用。 酸。磷酸化的 BMPR⁃Ⅰ再依次通过激活下游的一
系列细胞内底物信号蛋白,这些蛋白统称为受体调
3 讨 论
节 的 Smads(R ⁃ Smads),包 括 Smad1、Smad5 和
CAVD 涉及到主动脉瓣瓣叶进行性增厚、基质 Smad8。被磷酸化激活的 Smad1 或 Smad5 与 Co⁃
重塑以及钙盐沉积,从而导致瓣叶严重钙化、结构 Smads(Smad4)结合形成复合物后由胞浆进行核转
功能减退,最终发生瓣膜严重的狭窄和/或关闭不 位进入细胞核,调节各种靶基因的转录包括 Runx2
全 。随着研究的深入,CAVD 不再被认为是一个 和Msx2等,共同参与各种成骨细胞表型基因表达和
[2]
被动的、随着年龄的增长和钙沉积,瓣膜进行性退 分化 [16] 。用外源的 BMP2,如 rhBMP2,可以启动该
化的过程,而是一种“主动调控”的进行性疾病 [13] 。 信号通路,激活 Smads 复合物,在特异性转录因子
CAVD的发展过程包括慢性炎症、脂蛋白沉积、肾素⁃ Runx2的参与下调节下游靶基因的表达。
血管紧张素系统参与以及细胞外基质重塑,激活特 EGB761 是一种标准化的提取物,含有 24%的
定的成骨分化信号通路,参与瓣膜间质细胞从成纤 黄酮糖苷和 6%的萜烯内酯,如银杏内酯 A、B、C、J
维细胞/肌成纤维细胞转向成骨样细胞表型和细胞 和白果内酯。类黄酮具有清除自由基的作用,而萜
凋亡 [14] 。瓣膜间质细胞是主动脉瓣膜的主要细胞 烯内酯则保护线粒体膜免受自由基的破坏 [17] 。研
类型,在CAVD进展中起主要作用,它是目前探讨瓣 究报道,EGB761 可以稳定由于过量线粒体氧自由
膜钙化发生发展机制的主要方向 ,多项研究确定 基和过氧亚硝酸盐引起的线粒体膜电位的变化,并
[3]
了瓣膜间质细胞具有成骨分化和钙化的能力 。 有助于防止离子稳态的破坏,起到抗氧化的作用。
[15]
现有的研究证实多条信号通路均参与瓣膜钙 此外,还有学者发现,EGB761可以显著降低β⁃甘油
化的病理过程,如BMP2/Smad1/5/8、NF⁃κB⁃RANKL、 磷酸诱导的大鼠主动脉平滑肌细胞钙沉积,还抑制
Wnt⁃β⁃catenin和p38⁃MAPK通路等 [12] 。众多学者对 成骨分化,这可能与减少ALP的表达有关;此外,它
成骨因子 BMP2/Smads/Runx2 信号转导通路进行了 还下调NF⁃κB活性,并减少血管平滑肌细胞氧自由
深入的研究。BMP2 通过结合靶细胞表面 2 种丝氨 基的产生,有潜力作为临床上预防和治疗血管钙化
酸/苏氨酸激酶受体(BMPR⁃Ⅰ,BMPR⁃Ⅱ)向胞内传 的一种手段 [10-11] 。
递信号。首先 BMP2 与细胞膜上 BMPR⁃Ⅱ结合后, 本研究使用国际上认可的体外诱导瓣膜间质