Page 30 - 南京医科大学学报自然科学版
P. 30
第41卷第8期
·1132 · 南 京 医 科 大 学 学 报 2021年8月
A B
Control shRNA1 shRNA3 Control shRNA1 shRNA3
( 个 ) 100 * **
80
40
C D 克隆细胞数量 60
0 h 12 h 24 h 20
( % ) 80 0 Control shRNA1 shRNA3
Control h修复率 60 * ** D Control shRNA1 shRNA3
40
划痕12 20 0
shRNA1 Control shRNA1 shRNA3
( 个 ) 1 500 * **
1 000
shRNA3 侵袭细胞数量 500
0
Control shRNA1 shRNA3
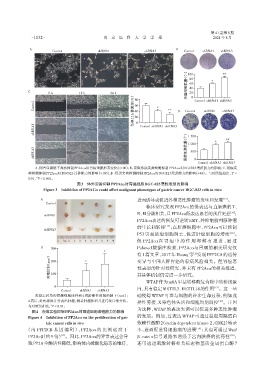
A:倒置显微镜下观察抑制PP2Acα后胃癌细胞形态变化(×100);B:克隆形成实验检测抑制PP2Acα对BGC823增殖能力的影响;C:划痕实
*
验检测抑制PP2Acα对BGC823迁移能力的影响(×100);D:侵袭实验检测抑制PP2Acα对BGC823侵袭能力的影响(×40)。与对照组相比,P <
0.01,P < 0.001。
**
图3 体外实验抑制PP2Acα对胃癌细胞BGC⁃823恶性表型的影响
Figure 3 Inhibition of PP2ACα could affect malignant phenotypes of gastric cancer BGC⁃823 cells in vitro
[13]
A 进而诱导或促进各种恶性肿瘤的发生和发展 。
Control
临床研究发现 PP2Acɑ的低表达与直肠癌的 T、
[14]
N、M分期相关,且PP2Acɑ低表达患者的预后更差 ;
shRNA1
PP2Acɑ表达的恢复可逆转EMT,并抑制前列腺肿瘤
的生长和转移 [15] ;在肝癌细胞中,PP2Acɑ可以抑制
shRNA3
P53 引起的癌细胞凋亡,促进肝癌细胞的增殖 [16] 。
但 PP2Acɑ 在 胃 癌 中 的 作 用 却 鲜 有 报 道 ,通 过
B 300 Pubmed 数据库检索,PP2Acɑ与胃癌的相关研究仅
* 有1篇文章,2017年Huang等 发现PPP2CA的遗传
[2]
( mm 3 ) 200 * 变异与中国人群胃癌的患病风险相关。但胃癌恶
肿瘤体积 100 性表型的针对性研究,并未有 PP2Acɑ的相关报道,
其具体机制仍需进一步研究。
WTAP作为m6A甲基转移酶复合物中的桥接蛋
0 白,具有稳定METTL3、METTL14的作用 [17] 。这一基
Control shRNA1 shRNA3
将稳定转染的胃癌细胞接种到 4 周龄雌性裸鼠的腋下(n=4); 础使得 WTAP 可参与细胞的许多生命过程,例如选
4 周后,处死裸鼠并分离出肿瘤,测量肿瘤体积并进行统计学分析。 择性剪接,X 染色体失活和细胞周期调控 [18] 。正因
与对照组相比,P < 0.05。 为这样,WTAP 的表达失调可以促进多种恶性肿瘤
*
图4 在体实验抑制PP2Acα对胃癌细胞增殖能力的影响
Figure 4 Inhibition of PP2Acα on the proliferation of gas⁃ 的发展。例如,过表达 WTAP 可通过稳定周期蛋白
tric cancer cells in vivo 依赖性激酶2(cyclin dependent kinase 2,CDK2)转录
(由 PPP2CB 基 因 编 码),PP2Acα 的 比 例 远 高 于 本,进而促进肾细胞癌的进展 [19] ;其也可通过 Wnt/
[12]
PP2Acβ(约 9 倍) 。因此,PP2Acα的异常表达会导 β⁃catein 信号通路来增强子宫内膜癌的抗药性 [20] ;
致PP2A全酶活性降低,影响体内磷酸化稳态的维持, 还可通过刺激转移相关标志物基质金属蛋白酶 7