Page 42 - 南京医科大学学报自然科学版
P. 42
第41卷第8期
·1144 · 南 京 医 科 大 学 学 报 2021年8月
A B C
15.0 P<2.22×10 -16 1.00 高表达 1.00
低表达
SOX12相对表达 12.5 总生存率 0.75 真阳性率 0.75
0.50
0.50
10.0
0.25
7.5 P=0.024 0.25 1年AUC=0.679
3年AUC=0.636
0.00 5年AUC=0.617
0.00
肿瘤组织 正常组织 0 1 000 2 000 3 000
时间(d) 0.00 0.25 0.50 0.75 1.00
假阳性率
D E F
P=0.160 P=0.170 P=0.004
P=0.110
P=0.680
P=0.001
P=0.004 P=0.220 16 P=0.018 16 P=0.002
SOX12相对表达量 15 P=0.003 SOX12相对表达量 12 SOX12相对表达量 12
P=0.001
14
14
10
10
10
G1 G2 G3 G4 8 StageⅠ StageⅡ StageⅢ StageⅣ 8 T1 T2 T3 T4
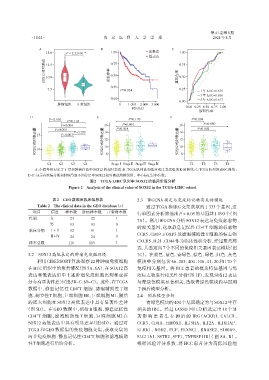
A:小提琴图显示了正常和肿瘤样品中 SOX12 的相对表达;B:TCGA 队列高和低 SOX12 表达组的 K⁃M 曲线;C:TCGA 队列的 tROC 曲线;
D~F:显示在疾病分期和肿瘤等级不同分层中SOX12相对表达的箱线图。中心标记是中位数。
图2 TCGA⁃LIHC队列中 SOX12的临床价值分析
Figure 2 Analysis of the clinical value of SOX12 in the TCGA⁃LIHC cohort
表2 GEO数据库临床信息表 2.3 WGCNA确定与免疫标记物有关的模块
Table 2 The clinical data in the GEO database(n) 通过TCGA和IRG交集获取的1 333个基因,进
项目 信息 样本数 肿瘤样本数 正常样本数 行单因素分析筛选出P < 0.05的基因共1 090个(图
性别 女 023 022 1
7A)。利用 WGCNA 分析 SOX12 表达与免疫标志物
男 093 093 0
的相关基因,选取静息记忆性CD4 T 细胞的标志物
+
临床分期 Ⅰ+Ⅱ 092 091 1
CCR5、CD69、FOXP3 及滤泡辅助性 T 细胞的标志物
Ⅲ+Ⅳ 024 024 0
CXCR5、IL21、CD44作为临床性状分析,经过聚类筛
样本总数 116 115 1
选,共鉴定出7个不同的免疫相关基因表达模块(图
2.2 SOX12高低表达的肿瘤免疫微环境 7C)。在黄色、蓝色、青绿色、棕色、绿色、红色、灰色
利用CIBERSORT算法观察22种肿瘤免疫细胞 模块中分别包含 66、283、404、106、41、20 和 170 个
在HCC组织中的聚类情况(图5A、6A),在SOX12高 免疫相关基因。将 HCC 患者的模块特征基因与免
表达和低表达组中上述肿瘤免疫细胞比例和亚群 疫标志物进行相关性分析(图7F),发现SOX12表达
分布有显著性差异(图5B~C、6B~C)。此外,在TCGA 与青绿色模块显著相关,选取青绿色模块内基因用
数据中,静息记忆性 CD4 T 细胞、滤泡辅助性 T 细 于预后模型分析。
+
胞、调节性T细胞、巨噬细胞M0、巨噬细胞M1、激活 2.4 预后模型分析
的肥大细胞在 SOX12 高低表达中具有显著性差异 青绿色模块的404个基因确定为与SOX12生存
(图 5D)。在 GEO 数据中,初始 B 细胞、静息记忆性 相关的 IRG。经过 LASSO 回归分析选定出 18 个显
CD4 T 细胞、滤泡辅助性 T 细胞、巨噬细胞 M2 在 著 影 响 患 者 生 存 预 后 的 IRG(ACKR1、CALCR、
+
SOX12 高低表达中具有明显差异(图 6D)。通过对 CCR3、CD8A、HMOX1、IL15RA、IL12A、IL18RAP、
TCGA 和 GEO 数据集的免疫细胞交集,获取交集的 KLRK1、NOD2、PGF、PLXNC1、RNASE2、S100A9、
两个免疫细胞:静息记忆性CD4 T 细胞和滤泡辅助 SLC11A1、SSTR2、SPP1、TNFRSF11B)(图 8A、B)。
+
性T细胞进行后续分析。 根据风险评分系数,将 HCC 患者分为高低风险组