Page 10 - 南京医科大学学报自然科学版
P. 10
第42卷第8期
·1052 · 南 京 医 科 大 学 学 报 2022年8月
2.3 FRET 技 术 检 测 活 细 胞 中 LRP6 膜 受 体 与 WNT3A平均FRET效率为26.51%,平均供受体距离
WNT3A的相互作用 为 7.17 nm,处于 FRET 效率(8%~95%)及供受体距
使用 SP⁃ECFP⁃LRP6 及 SP⁃EYFP⁃WNT3A 质粒 离(3~8 nm)的有效区域。该结果显示,通过 FRET
共转染 293T 细胞,24 h 后进行 FRET 实验并计算 优化策略,在细胞膜上定量检测到 LRP6 膜受体与
FRET效率及FRET距离(图3)。LRP6⁃ECFP通道显 WNT3A的相互作用。
示 LRP6 膜定位较为明显;WNT3A⁃EYFP 通道显示
3 讨 论
WNT3A 与 LRP6 相互作用后细胞膜定位也较为显
著;经背景校正计算后的 FRET(校正)通道显示在 FRET 技术是研究活细胞中蛋白质相互作用及
细胞膜上 LRP6 与 WNT3A 有 FRET 现象发生;敏化 动态变化的有效手段,为阐明细胞生理过程和病理
荧光发射FRET计算得到FRET效率图像(FRET Ef⁃ 过程的机制提供了重要帮助。然而,FRET 技术用
ficiency)及供受体距离图像(D⁃A Distance)。红色 于检测膜受体与胞外配体相互作用及动态变化时,
箭头所指细胞膜区域 LRP6 及 WNT3A 细胞膜定位 存在诸多限制因素。首先,经典 FRET 技术检测距
较为明显。对细胞膜区域发生 FRET 现象的细胞 离要求FRET荧光对的距离在10 nm以内。但是,部
(n=25)进行 FRET 效率及距离统计分析,LRP6 与 分膜受体家族成员的胞外段较长,当受体与其配体在
A B
N端 LRP6 Wnt3a LRP6 Wnt3a
C端
E3
ECFP EYFP ECFP EYFP
440 nm 527 nm
E4 440 nm 476 nm <=10 nm
N端
C端
A:LRP6蛋白部分的三级结构(PDB ID:3S8Z)(左图);WNT3A蛋白的三级结构(PDB ID:7DRT)(右图),蓝色框为WNT3A与LRP6相互作
用区域;B:LRP6与WNT3A相互作用的FRET实验模型图。
图1 LRP6与WNT3A蛋白相互作用的FRET模式图
Figure 1 A diagram FRET pattern of LRP6 and WNT3A interaction
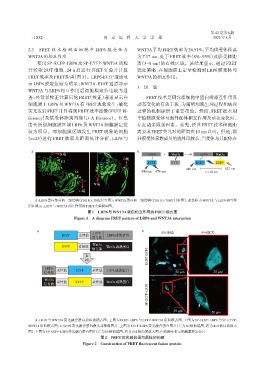
A LRP6 B 60×油镜 4×4放大
ECFP 连接肽 LRP6成熟蛋白
信号肽
Wnt3a
EYFP 连接肽 Wnt3a成熟蛋白
信号肽
重 ECFP⁃LRP6
构
LRP6 柔性肽 柔性肽
信号肽 ECFP LRP6成熟蛋白 50 μm 20 μm
Wnt3a
信号肽 柔性肽 EYFP 柔性肽 Wnt3a成熟蛋白
SP⁃ECFP⁃LRP6
50 μm
20 μm
A:LRP6 与 WNT3A 荧光融合蛋白质粒的模式图,上图为 ECFP⁃LRP6 与 EYFP⁃WNT3A 质粒模式图,下图为 SP⁃ECFP⁃LRP6 与 SP⁃EYFP⁃
WNT3A质粒模式图;B:LRP6荧光融合蛋白激光共聚焦图片,上图为ECFP⁃LRP6荧光融合蛋白图片(左为60倍油镜图,右为4×4倍局部放大
图),下图为SP⁃ECFP⁃LRP6荧光融合蛋白图片(左为60倍油镜图,右为4×4倍局部放大图,白色箭头指示细胞膜亚定位)。
图2 FRET荧光融合蛋白质粒的构建
Figure 2 Construction of FRET fluorescent fusion protein