Page 11 - 南京医科大学学报自然科学版
P. 11
第42卷第8期 马廷政,曹平平,汪徐春,等. 利用FRET技术检测膜受体与胞外配体相互作用的优化策略[J].
2022年8月 南京医科大学学报(自然科学版),2022,42(08):1049-1054 ·1053 ·
LRP6⁃ECFP通道 FRET通道(未校正) WNT3A⁃EYFP通道
4 095 4 095 4 095
3 071 3 071 3 071
2 047 2 047 2 047
1 023 1 023 1 023
10 μm 0 10 μm 0 10 μm 0
FRET通道(已校正) FRET Efficiency D⁃A Distance
4 095 100.00 100.00
3 071 75.000 75.000
2 047 50.000 50.000
1 023 25.000 25.000
10 μm 0 10 μm 0.0000 0.0000
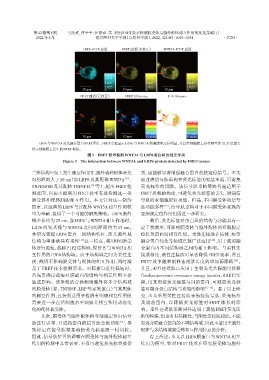
LRP6与WNT3A荧光融合蛋白FRET图片,FRET实验显示LRP6与WNT3A细胞膜亚定位明显,并且在细胞膜上存在相互作用,红色箭头
指示细胞膜上发生的FRET现象。
图3 FRET技术检测WNT3A与LRP6蛋白间的相互作用
Figure 3 The interaction between WNT3A and LRP6 protein detected by FRET assays
三维结构空间上发生相互作用时,胞外端和配体荧光 割,也能够显著增强融合蛋白的膜定位信号。本文
[11]
对的距离大于10 nm(如 LRP6 及其配体 WNT3A 、 通过将信号肽重构在荧光标签的氨基末端,可避免
[12]
TNFRSF6B 及其配体 TNFSF14 等),超出 FRET 检 荧光标签的切除。该信号肽重构策略普遍适用于
测范围,因而不能利用 FRET 技术有效检测这一类 FRET质粒的构建,可避免荧光标签的丢失,增强信
膜受体和配体间的相互作用。本文针对这一制约 号肽的亚细胞定位功能。但是,不同膜受体的信号
因素,以经典的LRP6与其配体WNT3A相互作用模 肽功能多样 [15] ,信号肽重构对于不同膜受体家族的
型为基础,提供了一个可能的解决策略。LRP6胞外 亚细胞定位作用仍需进一步研究。
域全长约为25 nm,当LRP6与WNT3A相互作用时, 最后,荧光标签对蛋白质的结构与功能具有一
LRP6 的氨基端与 WNT3A 之间的距离约为 15 nm。 定干扰效应,可影响膜受体与胞外配体的亚细胞定
本研究依据 LRP6 蛋白三级结构特征,即其胞外域 位以及蛋白间相互作用。柔性连接肽在抗体、标签
结构为串珠状具有柔性 [13] 这一特点,将 LRP6 膜受 融合蛋白纯化等领域已被广泛应用 [14] ,用于减弱融
体进行截短,截掉P1P2结构域,保留其与WNT3A相 合蛋白内不同结构域之间的相互影响。与柔性连
互作用的 P3P4 结构域。由于结构域之间为柔性连 接肽相比,刚性连接肽可显著降低FRET效率,并且
接,截短不影响膜受体与配体的相互作用,同时满 FRET 效率随着刚性连接肽长度的增加而降低 [16] 。
足了 FRET 技术检测要求。对膜蛋白进行截短时, 并且,柔性连接肽已应用于生物发光共振能量转移
首先要确定截短对膜蛋白的结构与相互作用不会 (bioluminescence resonance energy transfer,BRET)实
造成影响。该策略适合检测细胞外有多个结构域 验,用来衔接荧光标签与目的蛋白,可减弱荧光标
的膜受体(如:TNFRSF、LRP 等家族蛋白)与其配体 签对融合蛋白结构与功能的影响 [17-18] 。基于以上研
的相互作用;且特别适用于检测有明确相互作用但 究,本文采用柔性连接肽来衔接信号肽、荧光标签
需要进一步在活细胞水平观察其相互作用动态变 及成熟蛋白,以降低荧光标签对 FRET 体系的影
化的配体和受体。 响。柔性连接肽策略同样适用于其他FRET荧光质
其次,膜受体与胞外配体的亚细胞定位由信号 粒的构建,但也有其局限性,与刚性连接肽相比,不能
肽进行引导,且成熟蛋白的信号肽会被切除 [14] ,导 有效分隔融合蛋白的不同结构域,因此不适用于胞外
致标记在信号肽氨基端的荧光标签被一同切除。 配体与多结构域膜受体相互作用位点的分析。
因此,信号肽位置的调整在膜受体与胞外配体相互 综上所述,本文以 LRP6 膜蛋白与 WNT3A 相互
作用的检测中非常必要,不仅可避免荧光标签被切 作用为模型,针对 FRET 技术在研究膜受体与胞外