Page 20 - 南京医科大学学报自然科学版
P. 20
第42卷第8期
·1062 · 南 京 医 科 大 学 学 报 2022年8月
A Iba1 DAPI Merge B
4
对照组 Iba1相对荧光强度 3 2 **
TBI组 1 0 ##
TBI组
对照组 TBI+SK 1 mg/kg组
mg/kg组
5
TBI+SK
C 对照组 TBI组 TBI+SK 5 mg/kg组 D 对照组
2.0
TBI组
NF⁃κB 65 kDa ** TBI+SK 5 mg/kg组
蛋白相对表达 1.0 **
NLRP3 110 kDa 1.5 * # # **
22 kDa
ASC **
Caspase1 50 kDa 0.5 ## ## ##
IL⁃1β 31 kDa
0
GAPDH 37 kDa NF⁃κB NLRP3 Caspase1 ASC IL⁃1β
SK 0.3 μmol/L组
E 1.5 G 1.5
SK 3 μmol/L组
对照组 LPS+ATP组 SK 1 μmol/L组 SK 10 μmol/L组 F 1.0 ** # # normlized to GAPDH 1.0 **
NLRP3 110 kDa normlized to GAPDH # # # # #
Caspase1 50 kDa 0.5 0.5
GAPDH 37 kDa 0 caspase1 0
对照组 SK 1 μmol/L组 对照组 SK 1 μmol/L组
SK 3 μmol/L组
SK 10 μmol/L组
LPS+ATP组
SK 0.3 μmol/L组
SK 3 μmol/L组
SK 10 μmol/L组
LPS+ATP组
SK 0.3 μmol/L组
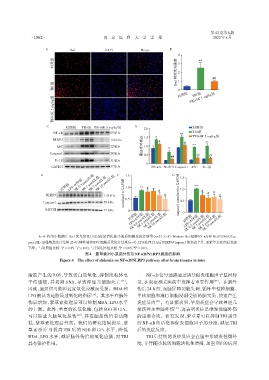
A~B:各组小鼠脑片 Iba1 荧光染色(×20)标记活化的小胶质细胞及统计结果(n=3);C~D:Western blot 检测 NF⁃κB 和 NLRP3/ASC/Cas⁃
pase1/IL⁃1β通路及统计结果;E~G:体外培养BV2细胞系及统计结果(n=4),LPS处理12 h后NLRP3/Caspase1的表达上升,而紫草素处理后表达
下降。与对照组比较,P < 0.05,P < 0.01,与TBI/LPS组比较,P < 0.05,P < 0.01。
##
**
#
*
图4 紫草素对小鼠脑外伤后NF⁃κB/NLRP3通路的影响
Figure 4 The effect of shikonin on NF⁃κB/NLRP3 pathway after brain trauma in mice
清除产生的 ROS,导致蛋白质氧化,抑制线粒体电 NF⁃κB信号通路通过诱导促炎细胞因子基因转
子传递链,并切割 DNA,导致神经元细胞死亡 [17] 。 录,在炎症相关疾病中发挥着重要作用 [20] 。在脑外
因此,脑组织可能因过度氧化应激而受损。MDA和 伤后24 h内,血脑屏障功能失调,循环中性粒细胞、
LPO被认为是脂质过氧化的指标 [18] 。其水平在脑外 单核细胞和淋巴细胞浸润受损的脑实质,快速产生
伤后增加,紫草素处理后可以抑制 MDA、LPO 水平 炎症反应 [21] 。有证据表明,早期炎症会导致神经元
的上调。此外,重要的抗氧化酶,包括 SOD 和 GPx, 损伤并加重脑外伤 [22] ,这表明炎症是继发性脑外伤
可以防止大脑氧化损伤 [19] ,其在脑损伤后表达降 的重要介质。研究发现,紫草素可以抑制 TBI 诱导
低,紫草素处理后升高。我们的研究结果提示,紫 的 NF⁃κB 的活化和促炎细胞因子的分泌,减轻 TBI
草素治疗可提高 TBI 后的 SOD 和 GPx 水平,降低 后的炎症反应。
MDA、LPO 水平,减轻脑外伤后的氧化应激,对 TBI TBI后持续的炎症反应会在脑中形成炎性微环
具有保护作用。 境,并伴随小胶质细胞活化和增殖,加重TBI的病理