Page 70 - 南京医科大学学报自然科学版
P. 70
第43卷第5期
·652 · 南 京 医 科 大 学 学 报 2023年5月
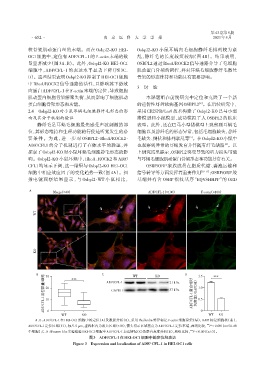
核骨架肌动蛋白丝的末端。而在 Osbpl2⁃KO HEI⁃ Osbpl2⁃KO 小鼠耳蜗内毛细胞静纤毛排列较为紊
OC1 细胞中,定位有 ADF/CFL⁃1 的 F⁃actin 末端的数 乱,静纤毛的长度较短较细(图 4B)。结果表明,
量显著减少(图 3A、B)。此外,Osbpl2⁃KO HEI⁃OC1 OSBPL2 通过 RhoA/ROCK2 信号通路介导了毛细胞
细胞中,ADF/CFL⁃1 的表达水平显著下降(图 3C、 肌动蛋白骨架的调控,并对耳蜗毛细胞静纤毛微丝
D)。这些结果表明Osbpl2⁃KO抑制了HEI⁃OC1细胞 骨架的形态维持和功能具有重要影响。
中 RhoA/ROCK2 信号通路的活性,且影响其下游效
3 讨 论
应蛋白ADF/CFL⁃1在F⁃actin 末端的定位,导致细胞
肌动蛋白细胞骨架解聚失衡,从而影响了细胞肌动 本课题组在前期研究中定位和克隆了一个新
[2]
蛋白细胞骨架形态和功能。 的遗传性耳聋致病基因OSBPL2 。在后续研究中,
2.4 Osbpl2⁃KO对小鼠耳蜗毛细胞静纤毛形态的影 采用 CRISPR/Cas9 技术构建了 Osbpl2⁃KO 巴马小型
响及其分子机制的验证 猪模型和小鼠模型,成功模拟了人 OSBPL2 的临床
静纤毛是耳蜗毛细胞最先感受声波刺激的部 表型。此外,还在巴马小型猪模型上观察到耳蜗毛
位,其形态维持和生理功能的行使是听觉发生的必 细胞以及静纤毛的形态异常,包括毛细胞缺失,静纤
[3]
要条件。为此,进一步对 OSBPL2⁃RhoA/ROCK2⁃ 毛缺失、倒伏和排列紊乱等 。在Osbpl2⁃KO小鼠中
[4]
ADF/CFL1 的分子机制进行了在体水平的验证,并 也观察到异常的耳蜗发育并伴随有纤毛缺陷 。以
探索了Osbpl2⁃KO对小鼠耳蜗毛细胞静毛形态的影 上研究结果提示,OSBPL2突变导致的听力损失可能
响。Osbpl2⁃KO 小鼠耳蜗中,RhoA、ROCK2 和 ADF/ 与耳蜗毛细胞肌动蛋白骨架形态和功能异常有关。
CFL1 均显示下调,这一结果与 Osbpl2⁃KO HEI⁃OC1 OSBP/ORP 家族成员在脂质代谢、囊泡运输和
细胞中相应效应因子的变化趋势一致(图 4A)。扫 信号转导等方面发挥着重要作用 [10-11] :OSBP/ORP羧
描电镜观察结果显示,与 Osbpl2⁃WT 小鼠相比, 基端共有含 OSBP 指纹基序“EQVSHHPP”的 ORD
A Merge(×40) ADF/CFL⁃1(×100) F⁃actin(×100)
WT
KO
B 30 *** C ADF/CFL⁃1 WT KO 21 kDa D 1.5 ***
ADF/CFL⁃1定位数量/细胞 20 GAPDH 37 kDa ADF/CFL⁃1蛋白相对 ( /GAPDH) 灰度值 1.0
0.5
10
0
WT KO 0 WT KO
A、B:ADF/CFL⁃1 在 HEI⁃OC1 细胞中的定位(A)及数据分析(B),采用 Phalloidin 特异标记 F⁃actin 细胞骨架(绿),DAPI 标记细胞核(蓝),
***
ADF/CFL⁃1定位区域(红),标尺5 μm,虚线框内为放大区域(×10),箭头指示区域亮点为ADF/CFL⁃1定位末端,两组比较, P<0.001(n=50~60
个细胞);C、D:Western blot实验检验HEI⁃OC1细胞中ADF/CFL⁃1表达情况(C)及蛋白灰度分析(D),两组比较, P<0.001(n≥3)。
***
图3 ADF/CFL⁃1在HEI⁃OC1细胞中的定位和表达
Figure 3 Expression and localization of ADF/ CFL⁃1 in HEI⁃OC1 cells