Page 16 - 南京医科大学学报自然科学版
P. 16
第43卷第7期
·902 · 南 京 医 科 大 学 学 报 2023年7月
3号染色体
hbba2 hbaa2 hbaa1 hbba1 hbbe1.1 hbae1.1 hbbe1.2 hbae1.2 hbbe1.3 hbae1.3 hbae3
β成熟期 α成熟期 α成熟期 β成熟期 β胚胎期 α胚胎期 β胚胎期 α胚胎期 β胚胎期 α胚胎期 α胚胎期
Cas9 Cas9
hbba2 hbae3
HB⁃2⁃F1 H6⁃1⁃F 靶点序列 H5⁃2⁃F 靶点序列
GGAGAAAGCTGTCAAGAACG GAAGGGAGGTTTGCTGACCC
HB⁃2⁃R1 H5⁃2⁃F H5⁃12⁃R
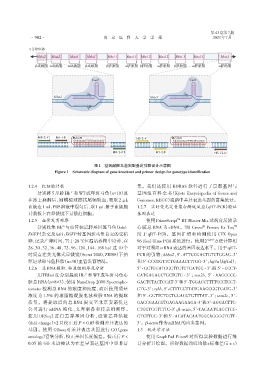
图1 基因敲除及基因型鉴定引物设计示意图
Figure 1 Schematic diagram of gene knockout and primer design for genotype identification
1.2.4 红细胞计数 集。我们还使用 KOBAS 软件进行了京都基因与
分别将 5 月龄 Hb 和 WT 成年斑马鱼(n=10)放 基因组百科全书(Kyoto Encyclopedia of Genes and
+/-
在冰上麻醉后,酒精棉球擦拭尾柄取血,吸取 2 μL Genomes,KEGG)通路中差异表达基因的富集统计。
血液在1 mL PBS溶液中混匀后,取1 μL置于血细胞 1.2.7 实时荧光定量聚合酶链反应(qRT⁃PCR)验证
计数板上在显微镜下计数红细胞。 基因表达
1.2.5 血管发育观察 使用PrimeScript RT Master Mix 试剂盒反转录
TM
分别收集Hb 与血管标记转基因斑马鱼(kdrl: 心脏总 RNA 为 cDNA。TB Green Premix Ex Taq TM
+/-
®
EGFP)杂交及kdrl:EGFP转基因斑马鱼自交的受精 用于 qRT⁃PCR。基因扩增和检测使用 CFX Opus
卵,记录产卵时间,置于28 ℃恒温培养箱中培养,在 96 Real⁃Time PCR系统进行。使用2 -ΔΔCT 方法计算相
28、30、32、36、48、72、96、120、144、168 hpf 这 10 个 对于对照组mRNA表达的基因表达水平。用于qRT⁃
时间点在荧光体式显微镜(Stemi 2000,ZEISS)下拍 PCR 的引物:hbba2,5′⁃ATTGCGAGTGTCTGGAG⁃3′
照记录斑马鱼胚胎(n=30)血管发育情况。 和 5′⁃CCGTGTTCTGAAACTTTGG⁃3′;hif3a(hif1al),
1.2.6 总RNA提取、转录组测序及分析 5′ ⁃ GCTGGATGGCTTGTCTGATGG ⁃ 3′ 和 5′ ⁃ CCCT⁃
用TRIzol法分别提取Hb 和WT成年斑马鱼心 CATGAGAGCTGCTGTG ⁃ 3′ ;nos2b,5′ ⁃ AAGCCCC⁃
+/-
脏总RNA(n=8×3),使用 NanoDrop 2000 Spectropho⁃ GACTCTACTCCAT⁃3′和5′⁃TGGACCTTTTCCCTCCT⁃
tometer 检测总 RNA 的浓度和纯度,而后使用质量 GTG⁃3′;cybb,5′⁃CTTTCGTTATGAAGCGGTGATG⁃3′
浓度为 1.5% 的琼脂糖凝胶电泳检验 RNA 的提取 和 5′⁃GGTTCTCCTGGACGTGTTTAT⁃3′;tnnt2c,5′⁃
质量。将提取后的总 RNA 提交至北京安诺优达 GACCGAACGTGAGAAGAAGA⁃3′和5′⁃AGGACTTC⁃
公司进行 mRNA 纯化、文库制备和转录组测序。 CTGGTGGTTTTC⁃3′;β⁃actin,5′⁃TACAATGAGCTCC⁃
使用 DESeq2 进行差异基因分析,设置差异倍数 GTGTTGC⁃3′和 5′⁃ACATACAATGGCAGGGGTGTT⁃
(fold change)>2 且校正后 P < 0.05 检测差异表达的 3′。β⁃actin作为mRNA的内参基因。
基因。使用 GOseq 对差异表达基因进行 GO(gene 1.3 统计学方法
ontology)富集分析,校正基因长度偏差。校正后P < 使用 GraphPad Prism9 对所得实验数据进行统
0.05 的 GO 术语被认为在差异表达基因中显著富 计分析并绘图。所得数据均以均数±标准差(x ± s)