Page 30 - 南京医科大学自然版
P. 30
第44卷第6期
·766 · 南 京 医 科 大 学 学 报 2024年6月
A TPC⁃1 B KTC⁃1
sh⁃Vehicle sh⁃UBE2T sh⁃Vehicle sh⁃UBE2T
(%) 150 TPC⁃1 (%) 150 KTC⁃1
Wound closure rate 50 Wound closure rate 50
0 h 100 *** 0 h 100 **
0
0
sh⁃Vehicle sh⁃UBE2T sh⁃Vehicle sh⁃UBE2T
h h
24 24
C Migration D Invasion
sh⁃Vehicle sh⁃UBE2T sh⁃Vehicle sh⁃UBE2T
sh⁃Vehicle sh⁃Vehicle
Migration cells per field 50 ** Invasion cells per field 50 **
sh⁃UBE2T
sh⁃UBE2T
TPC⁃1 150 ** TPC⁃1 150 **
100
100
KTC⁃1 0 TPC⁃1 KTC⁃1 KTC⁃1 0 TPC⁃1 KTC⁃1
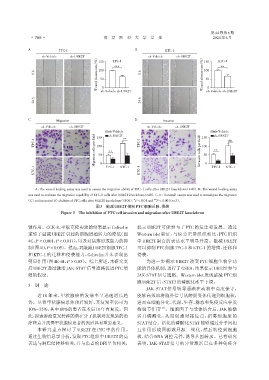
A:The wound healing assay was used to assess the migration ability of TPC⁃1 cells after UBE2T knockdown(×40). B:The wound healing assay
was used to evaluate the migration capability of KTC⁃1 cells after UBE2T knockdown(×40). C,D:Transwell assays was used to investigate the migration
**
(C)and invasion(D)abilities of PTC cells after UBE2T knockdown(×100). P < 0.01 and *** P < 0.001(n=3).
图3 敲减UBE2T抑制PTC细胞迁移、侵袭
Figure 3 The inhibition of PTC cell invasion and migration after UBE2T knockdown
键作用。CCK⁃8、平板克隆实验的结果显示Colivelin 提示 UBE2T 可能参与了 PTC 的发生和发展。通过
逆转了敲减UBE2T引起的细胞增殖活力的降低(图 Western blot 验证,与癌旁正常组织相比,PTC 组织
4C,P < 0.001,P < 0.01)),以及对集落形成能力的抑 中 UBE2T 蛋白的表达水平明显升高。敲减 UBE2T
制(图4D,P < 0.05)。然而,对敲减UBE2T细胞TPC⁃1 可以抑制 PTC 细胞 TPC⁃1 和 KTC⁃1 的增殖、迁移和
和 KTC⁃1 的迁移和侵袭能力,Colivelin 并未表现出 侵袭。
明显作用(图4E~H,P > 0.05)。综上所述,本研究支 为进一步揭示 UBE2T 改变 PTC 细胞生物学功
持UBE2T通过激活JAK⁃STAT信号通路促进PTC增 能的具体机制,进行了GSEA,结果提示UBE2T参与
殖的假设。 JAK⁃STAT信号通路。Western blot发现敲减 PTC细
胞UBE2T 后,STAT3的磷酸化水平下调。
3 讨 论
JAK⁃STAT 信号转导通路在动物中高度保守,
近 10 年来,甲状腺癌的发病率呈迅速增长趋 能够高效地将胞外信号从跨膜受体传递到细胞核,
势。尽管甲状腺癌总体预后较好,其复发率仍可为 进而在细胞分化、代谢、生存、稳态和免疫反应中发
10%~35%,其中80%的患者在术后10年内复发。因 挥调节作用 [17] 。细胞因子与受体结合后,JAK 被激
此,探索肿瘤复发转移的潜在分子机制对发现新的治 活并磷酸化,从而创建对接位点,招募细胞质的
疗靶点并改善甲状腺癌患者的预后具有重要意义。 STAT结合。活化的磷酸化STAT能够通过分子间相
本研究重点探讨了 UBE2T 在 PTC 中的作用。 互作用形成同源或异源二聚化,然后转位到细胞
通过生物信息学分析,发现PTC组织中UBE2T的高 核,结合 DNA 调控元件,诱导基因转录。已有研究
表达与淋巴结转移相关,并与患者的DFI呈负相关, 表明,JAK⁃STAT 信号的异常激活已在多种免疫介