Page 20 - 南京医科大学自然版
P. 20
第44卷第8期
·1048 · 南 京 医 科 大 学 学 报 2024年8月
A B C
Control
*** Ator+Fer⁃1
8 Control 2.5 Ator Control Ator
* Ator+Fer⁃1 GPX4 17 kDa
Ator
Relative mRNA expression 4 ** Relative mRNA expression 1.5 *** *** β⁃actin Control Ator Ator+Fer⁃1 42 kDa
*
2.0
6
1.0
2
4⁃HNE
0.5
42 kDa
β⁃actin 76 kDa
0 0
caspase⁃3 Ripk3 Ptgs2 Acsl4 Gpx4
D 2.0 ** E 1.5 **
protein expression 1.5 4⁃HNE protein expression 1.0
1.0
Relative GPX4 0.5 Relative 0.5
0
Control Ator Ator+Fer⁃1 0 Control Ator Ator+Fer⁃1
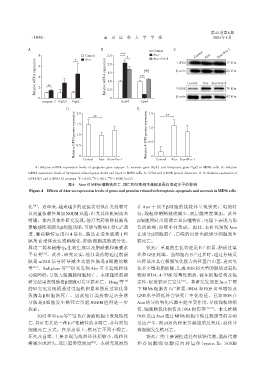
A:Relative mRNA expression levels of apoptosis gene caspase⁃ 3,necrosis gene Ripk3 and ferroptosis gene Ptgs2 in MIN6 cells. B:Relative
mRNA expression levels of ferroptosis related genes Acsl4 and Gpx4 in MIN6 cells. C:GPX4 and 4⁃HNE protein detection. D-E:Relative expression of
**
***
*
GPX4(D)and 4⁃HNE(E)proteins. P < 0.05,P < 0.01, P < 0.001(n=3).
图4 Ator对MIN6细胞铁死亡、凋亡和坏死相关基因及蛋白表达水平的影响
Figure 4 Effects of Ator on expression levels of genes and proteins related to ferroptosis,apoptosis and necrosis in MIN6 cells
化 [14] 。近年来,越来越多的证据表明他汀类药物可 在 Ator 干预下β细胞的线粒体呈现铁死亡电镜特
以剂量依赖性增加NODM 风险,但其具体机制尚未 征:线粒体嵴断裂或减少,双层膜密度增加。此外
明确。体内及体外研究发现,他汀类药物降低胰岛 β细胞同时出现凋亡和自噬特征,电镜下表现为染
素敏感性和胰岛β细胞功能,可能与影响L型Ca 通 色质浓缩,自噬小体形成。因此,本研究发现 Ator
2+
道、葡萄糖转运蛋白 4 易位、胰岛素受体底物 1 和 在诱导β细胞凋亡、自噬的同时也能诱导细胞发生
胰岛素受体表达或磷酸化、脂肪细胞成熟或分化、 铁死亡。
异戊二烯和辅酶 Q10生物生成以及脂联素和瘦素水 铁死亡重要的生化特征是 Fe 积累、脂质过氧
2+
平有关 [15] 。此外,研究证实,他汀类药物通过削弱 化和 GSH 耗竭。当细胞内 Fe 过多时,通过芬顿反
2+
胰岛 mTOR 信号转导减少功能性胰岛β细胞的数 应释放出具有极强氧化能力的羟基自由基,进而氧
量 [16] 。Sadighara 等 [17] 研究发现 Ator 可引起线粒体 化多不饱和脂肪酸,生成ROS和大量的脂质过氧化
功能障碍,导致大鼠胰腺细胞凋亡。本课题组前期 物如 MDA、4⁃HNE 等毒性物质,破坏细胞结构及稳
研究结果表明胰岛β细胞可发生铁死亡。Hong等 [18] 定性,促进铁死亡发生 [21] 。本研究发现在Ator 干预
的研究也发现镉通过引起铁积累和脂质过氧化导 下 MIN6 细胞内 Fe 积累、MDA 和 ROS 含量增加及
2+
致胰岛β细胞铁死亡。因此他汀类药物是否会诱 GSH 水平降低符合铁死亡生化特征。已知 ROS 在
导胰岛β细胞发生铁死亡引起 NODM 值得进一步 Ator 诱导的氧化应激中起主要作用,导致线粒体损
探索。 伤、细胞膜氧化损伤及DNA损伤等 [22-23] 。本文推测
2012年Dixon等 [19] 首次在肿瘤细胞中发现铁死 ROS 是由 Ator 通过 MIN6 细胞中铁过载诱导的芬顿
亡,并证实其是一种Fe 依赖性的非凋亡、非坏死的 反应产生,而 ROS 的积累引起脂质过氧化,最终导
2+
细胞死亡方式。在形态学上,铁死亡不同于凋亡、 致细胞发生铁死亡。
坏死及自噬,主要表现为线粒体体积缩小,线粒体 铁死亡的主要调控途径包括铁代谢、脂质代谢
嵴减少或消失,双层膜密度增加 [20] 。本研究观察到 和 谷 氨 酸/胱 氨 酸 反 向 转 运 体(systen Xc )/GSH/
-