Page 14 - 南京医科大学学报自然科学版
P. 14
第43卷第10期
·1340 · 南 京 医 科 大 学 学 报 2023年10月
-/-
+/+
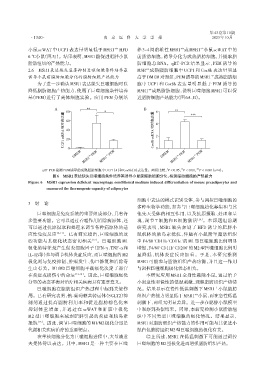
小鼠 scWAT 中 UCP1 表达量明显低于 MSR1 +/+ HFD 养 3~4 周龄雄性 MSR1 或 MSR1 小鼠 scWAT 中的
6 ℃小鼠(图5J)。结果表明,MSR1能促进肥胖小鼠 前脂肪细胞,诱导分化为成熟脂肪细胞,并提取脂
脂肪组织的产热能力。 肪细胞总 RNA。qRT⁃PCR 结果显示,PEM 诱导的
2.6 MSR1表达缺失显著抑制巨噬细胞条件培养基 MSR 成熟脂肪细胞中 UCP1 和 Cox8b 表达量明显
+/+
诱导小鼠前脂肪细胞分化的脂肪细胞产热能力 高于DMEM对照组;PEM诱导的MSR1 成熟脂肪细
-/-
为了进一步确认MSR1表达缺失巨噬细胞可以 胞中 UCP1 和 Cox8b 表达量明显低于 PEM 诱导的
降低脂肪细胞产热能力,使用了巨噬细胞条件培养 MSR1 成熟脂肪细胞,说明巨噬细胞 MSR1 可以促
+/+
基(PEM)进行了离体细胞实验。应用 PEM 分别培 进脂肪细胞产热能力(图6A、B)。
A ** B
80 * 6 ** ***
mRNA相对表达量 60 Cox8b mRNA相对表达量 4
40
UCP1 20 2
0 0
DMEM +/+ PEM -/- PEM DMEM +/+ PEM -/- PEM
MSR1 MSR1 MSR1 MSR1
qRT⁃PCR检测PEM诱导的成熟脂肪细胞中UCP1(A)和Cox8b(B)表达量。两组比较,P < 0.05,P < 0.01, P < 0.001(n=4)。
*
***
**
图6 MSR1表达缺失巨噬细胞条件培养基诱导小鼠前脂肪细胞分化,检测脂肪细胞的产热能力
Figure 6 MSR1 expression deficient macrophage conditioned medium induced differentiation of mouse preadipocytes and
measured the thermogenic capacity of adipocytes
细胞中表达的模式识别受体,参与调控巨噬细胞的
3 讨 论
多种生物学功能,如参与巨噬细胞趋化募集和与其
巨噬细胞是免疫系统的重要组成部分,具有许 他先天受体的相互作用,以及抗原摄取、处理和呈
多重要功能。它可以通过吞噬作用清除病原体,还 现,调节 T 细胞和 B 细胞激活 [16] 。本课题组前期
可以通过抗原摄取和处理来调节各种病原体的适 研究表明,MSR1 缺失加剧了 HFD 诱导的肥胖小
应性免疫反应 [9-11] 。已有研究指出,巨噬细胞的这 鼠机体的胰岛素抵抗,伴随有小鼠附睾脂肪组织
些功能与其极化状态密切相关 [12] 。巨噬细胞 M1 中 F4/80 CD11b CD11c 的 M1 型巨噬细胞比例明显
+
+
+
极化的特征是产生促炎细胞因子(IFN⁃γ、TNF⁃α和 增加,F4/80 CD11b CD206 的M2型巨噬细胞比例明
+
+
+
IL⁃1β等)参与调节机体炎症反应,而巨噬细胞的M2 显降低,机体炎症反应加重。于是,本研究推测
极化则与免疫抑制、肿瘤发生、伤口修复和清除寄 MSR1 可能参与脂肪组织产热功能,并且这一作用
生虫有关。M1/M2 巨噬细胞平衡极化决定了器官 与调控巨噬细胞极化状态相关。
在炎症或损伤中的命运 [13-14] 。因此,巨噬细胞极化 本研究应用 MSR1 全身性敲除小鼠,通过给予
分型的动态平衡对治疗相关疾病具有重要意义。 小鼠急性和慢性的低温刺激,观察脂肪组织产热情
巨噬细胞在脂肪组织产热过程中起到关键作 况。结果显示在慢性低温刺激下 MSR1 小鼠脂肪
-/-
用。已有研究表明,钠⁃葡萄糖共转运体(SGLT2)抑 组织产热能力明显低于MSR1 小鼠,而在急性低温
+/+
制剂通过提高脂肪利用率和促进脂肪棕色化来 刺激下,两组无明显差异。进一步在肥胖小鼠模型
抑制体重增加,并通过在 scWAT 和肝脏中极化 中观察到类似结果。同时,本研究检测小鼠脂肪组
M2 型巨噬细胞来减弱肥胖引起的炎症和胰岛素 织中不同类型巨噬细胞的极化情况。结果显示,
抵抗 [15] 。因此,调节巨噬细胞的M1/M2极化分型是 MSR1对脂肪组织产热能力的作用可能与其促进小
代谢相关疾病治疗的重要靶点。 鼠白色脂肪组织M2型巨噬细胞的极化有关。
在单核细胞分化为巨噬细胞进程中,大量清道 综上所述,MSR1 在低温刺激下可能通过调控
夫受体得以表达。其中,MSR1 是一种主要在巨噬 巨噬细胞的M2型极化进而增强脂肪组织产热。