Page 11 - 南京医科大学学报自然科学版
P. 11
第43卷第11期 王 舒,江婧月,王 迪,等. 羟氯喹介导NF⁃κB/NLRP3通路抑制M1型巨噬细胞极化缓解
2023年11月 小鼠肠道炎症[J]. 南京医科大学学报(自然科学版),2023,43(11):1479-1486 ·1483 ·
A 4
1 000 10
8.63
800 10 3
600
SSC CD11b 10 2
400
10 1
200 50.3
0 10 0 0 1 2 3 4
0 200 400 600 800 1 000 10 10 10 10 10
FSC CD45
对照组 DSS组 DSS+HCQ组
10 4 10 4 10 4
7.03% 12.10% 8.30% ( % )
10 3 10 3 10 3 15 ** *
CD86 10 2 10 2 10 2 10
10 1 10 1 10 1 M1型巨噬细胞比例 5
10 0 10 0 10 0 0
10 0 10 1 10 2 10 3 10 4 10 0 10 1 10 2 10 3 10 4 10 0 10 1 10 2 10 3 10 4 对照组 DSS组 DSS+HCQ组
F4/80
B
20 *** ** 5 4 *** 25 *** ***
IL⁃1β相对表达量 15 5 IL⁃12相对表达量 3 2 IL⁃23相对表达量 15
20
10
10
0 1 0 5 0
对照组 DSS组 DSS+HCQ组 对照组 DSS组 DSS+HCQ组 对照组 DSS组 DSS+HCQ组
10 8 *** 5 4 *** *** 2.5 *** ***
IL⁃6相对表达量 6 4 TNF⁃α相对表达量 3 2 iNOS相对表达量 1.5
2.0
1.0
0 2 1 0 0.5 0
对照组 DSS组 DSS+HCQ组 对照组 DSS组 DSS+HCQ组 对照组 DSS组 DSS+HCQ组
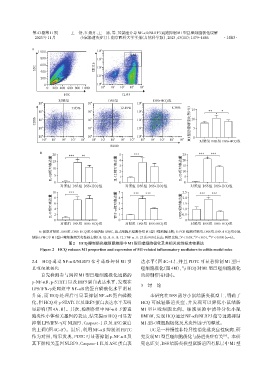
A:提取对照组、DSS组、DSS+HCQ组小鼠结肠LPMC,流式细胞术检测各组M1型巨噬细胞比例;B:PCR检测对照组、DSS组、DSS+HCQ组小鼠
结肠LPMC中M1型巨噬细胞相关炎性标志物(IL⁃1β、IL⁃6、IL⁃12、TNF⁃α、IL⁃23及iNOS)表达;两组比较,P < 0.05,P < 0.01, P < 0.001(n=6)。
*
**
***
图2 HCQ抑制肠炎模型鼠结肠中M1型巨噬细胞极化及其相关炎性标志物表达
Figure 2 HCQ reduces M1 proportion and expression of M1⁃related inflammatory mediators in colitis model mice
2.4 HCQ 通过 NF⁃κB/NLRP3 信号通路抑制 M1 型 达水平(图 4G~L),并且 PDTC 可显著抑制 M1 型巨
巨噬细胞极化 噬细胞极化(图4M),与 HCQ对M1型巨噬细胞极化
首先检测参与调控M1型巨噬细胞极化通路的 的抑制作用相同。
p⁃NF⁃κB、p⁃STAT1以及IRF5蛋白表达水平,发现在
3 讨 论
LPS/IFN⁃γ处理组中 NF⁃κB 的蛋白磷酸化水平明显
升高,而 HCQ 处理后可显著抑制 NF⁃κB 蛋白磷酸 本研究在 DSS 诱导小鼠结肠炎模型上,明确了
化,但HCQ对p⁃STAT1以及IRF5蛋白表达水平无明 HCQ 可减轻肠道炎症,并发现可以降低小鼠结肠
显影响(图4A、B)。其次,检测各组中NF⁃κB下游通 M1 型巨噬细胞比例。细胞实验中诱导分化小鼠
路炎性小体相关基因的表达,结果提示HCQ可显著 BMDM,发现HCQ通过NF⁃κB/NLRP3信号通路抑制
抑制 LPS/IFN⁃γ对 NLRP3、Caspase⁃1 以及 ASC 蛋白 M1型巨噬细胞极化及其炎性因子的释放。
的上调(图 4C~F)。最后,利用 NF⁃κB 抑制剂 PDTC UC是一种慢性非特异性消化道炎症性疾病,研
[16]
作为对照,结果发现,PDTC 可显著抑制 p⁃NF⁃κB 及 究发现M1型巨噬细胞极化与肠道炎症有关 。本研
其下游相关基因NLRP3、Caspase⁃1以及ASC蛋白表 究也证实,DSS结肠炎模型鼠肠道固有肌层中M1型