Page 42 - 南京医科大学学报自然科学版
P. 42
第43卷第2期
·184 · 南 京 医 科 大 学 学 报 2023年2月
A B
M 1 2 3 4 mAU UV
ConcB
100 1 400 M eluted IL3
70 1 200
55 100
40 1 000 70
35 55
25 800 40
250 mmol/L 35
600
15 25
400
10 200 15
kDa
0 kDa
mL
0 10 20 30 40 50 60 70 80 90 100
C D
mAU UV 0.4
Conductivity y=0.520 8x+0.083 3
140 M IL3 R =0.995 2
2
120 0.3
100 nm处吸光度
100 70 0.2
55
80 40
35 0.1
60 562 0.08 mg/mL
25
40 0.0
15 0.0 0.2 0.4 0.6 BSA(mg/mL)
20
Outlet 1 Waste
0
mL kDa
0 5 10 15 20 25 30 35 40
E
0.020
0.015
AU 0.010
0.005
0.000
0.00 10.00 20.00 30.00 40.00 50.00 60.00 时间(min)
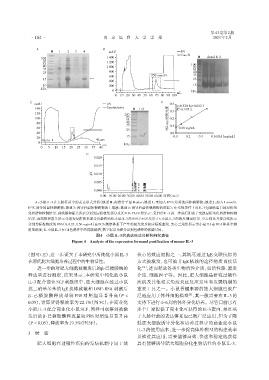
A:小鼠 IL⁃3 在大肠杆菌中的表达形式分析(泳道 M:标准分子量 Marker;泳道 1:未加入 IPTG 培养的菌体裂解物;泳道 2:加入 1 mmol/L
IPTG诱导的菌体裂解物;泳道3:诱导后菌体裂解物的上清液;泳道4:诱导后菌体裂解物的沉淀);B:变性条件下对IL⁃3包涵体蛋白的层析纯
化图谱和检测结果,虚线框和箭头所示分别为层析收集部分及其SDS⁃PAGE结果;C:复性后IL⁃3进一步进行阴离子交换层析纯化图谱和检测
结果,虚线框和箭头所示分别为层析收集部分及最终纯化小鼠IL⁃3的SDS⁃PAGE结果;D:小鼠IL⁃3的浓度测定结果,空心圆及其拟合线所示
分别为标准浓度的BSA(0、0.25、0.50 mg/mL)在BCA测定体系下产生的吸光度及相应标准曲线,实心三角形所示为小鼠IL3在BCA体系中测
定的浓度;E:小鼠IL⁃3在C4色谱柱中的洗脱图谱,数字标示为积分识别色谱峰的保留时间。
图4 小鼠IL⁃3的表达形式分析和纯化表征
Figure 4 Analysis of the expression formand purification of mouse IL⁃3
(图5D、E),进一步证实了本研究中所纯化小鼠IL⁃3 核心的效应细胞之一,其既可通过 IgE 交联抗原的
在原代肥大细胞培养过程中的生物活性。 方式被激发,也可被非 IgE 依赖的途径物质直接活
进一步的对肥大细胞被激发后的β⁃己糖胺酶的 化 [10] ,进而释放各类生物活性介质,如活性胺、脂质
释放量进行测定,结果显示,本研究中纯化的小鼠 介质、细胞因子等。因此,肥大细胞是研究过敏性
IL⁃3 配合商业 SCF 刺激组中,肥大细胞在经过小鼠 疾病及其他相关免疫炎症反应发生和发展机制的
抗二硝基苯基的 IgE 抗体致敏和 DNP⁃BSA 刺激后 重要工具之一。小鼠骨髓来源的肥大细胞已被广
[8]
β⁃己糖胺酶释放量较 PBS 对照组显著升高(P < 泛地应用于体外细胞模型 ,其一般需要在 IL⁃3 的
0.05),计算所得释放率为 22.1%(图 5C);在商业化 支持下进行4~6周的体外分化培养。尽管目前已有
小鼠 IL⁃3 配合商业化小鼠 SCF,同样可观察到被激 多个厂家提供了商业化可获得的IL⁃3蛋白,并且基
发后的β⁃己糖胺酶释放量较 PBS 对照组显著升高 于大肠杆菌的表达体系也已被广泛应用,但为了降
(P < 0.05),释放率为19.3%(图5F)。 低肥大细胞诱导分化和培养过程中的商业化小鼠
IL⁃3 的使用成本,进一步提高体外模型的构建效率
3 讨 论
并推进其应用,需要能够高效、快速和稳定地获得
肥大细胞在过敏性疾病的发病机制中属于最 具有能够诱导肥大细胞分化生物活性的小鼠 IL⁃3,