Page 11 - 南京医科大学学报自然科学版
P. 11
第43卷第8期 刘 瑾,黄 昀,李超普,等. VPS13A在3T3⁃L1脂肪细胞分化过程中的表达及调控研究[J].
2023年8月 南京医科大学学报(自然科学版),2023,43(8):1041-1046 ·1045 ·
A B
Ilochest Bodipy Ilochest Bodipy sg⁃NC sg⁃VPS13Λ
sg⁃NC sg⁃VPS13Λ
C 0 d 8 d
sg⁃NC sg⁃VPS13Λ sg⁃NC sg⁃VPS13Λ
VPS13Λ 360 kDa
43 kDa
CEBPα
CEBPβ 36 kDa
PPARγ 55 kDa
CALNEIN
90 kDa
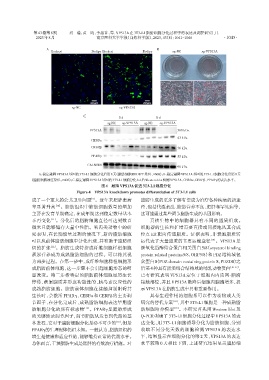
A:稳定敲降VPS13A基因的3T3⁃L1细胞分化后第8天(脂肪细胞BODIPY染色,×600);B:稳定敲降VPS13A基因的3T3⁃L1细胞分化后第8天
(脂肪细胞油红染色,×400);C:稳定敲降VPS13A基因的3T3⁃L1细胞分化8 d后Western blot检测VPS13A、CEBPα、CEBPβ、PPARγ的表达水平。
图4 敲降VPS13A促进3T3⁃L1细胞分化
Figure 4 VPS13A knockdown promotes differentiation of 3T3⁃L1 cells
成了一个重大的公共卫生问题 。近年来肥胖患病 脂肪生成的更多了解有望成为治疗各种疾病的新途
[9]
率显著升高 [10] 。脂肪组织中脂肪细胞数量的增加 径,包括代谢紊乱、脂肪营养不良、肥胖和罕见病等,
主要在发育早期确定,在成年期达到稳定数量基本 这可能通过某些调节脂肪生成的基因影响。
不再变化 [11] 。分化后的脂肪细胞直径可达到数百 真核生物中的细胞器具有不同的脂质组成。
微米且能够储存大量中性脂。啮齿类动物中的研 细胞器的生长和扩增需要直接或间接地从其合成
究表明,在长期能量过剩的情况下,新的脂肪细胞 位点 ER 靶向传递脂质。证据表明,非囊泡脂质转
可以从前体脂肪细胞中分化出现,并有助于脂肪组 运代表了大量脂质的主要运输途径 [15] 。VPS13A 是
织的扩张 [12] 。脂肪生成特指成纤维细胞样祖细胞 继氧化甾醇结合蛋白相关蛋白5/8(oxysterol binding
积累营养成为成熟脂肪细胞的过程。可以将其视 protein related proteins5/8,ORP5/8)和 PDZ 结构域包
为两步过程。在第一步中,成纤维细胞样祖细胞形 含蛋白8(PDZ domain containing protein 8,PDZD8)之
成脂肪前体细胞,这一步骤不会引起细胞形态的明 后第4种具有脂质结合结构域的哺乳动物蛋白 [16-17] ,
显改变。第二步指特定的脂肪前体细胞经历生长 已有研究表明 VPS13A 定位于细胞内内质网⁃脂滴
停滞,积累脂质并形成功能性的,胰岛素反应性的 接触部位,并且VPS13A敲降后细胞内脂滴增多,提
成熟脂肪细胞。脂肪前体细胞在接触抑制阻碍其 示VPS13A在脂肪生成中具有重要作用。
生长时,会激活 PPARγ、CEBPα和 CEBPβ的主要调 具有生理作用的细胞系可以作为动物或人类
节因子,在分化完成后,成熟脂肪细胞表达早期脂 研究的替代方案 [18] ,其中3T3⁃L1细胞是一种成熟脂
肪细胞分化的所有标志物 [13] 。PPARγ是脂肪形成 肪细胞培养模型 [19] 。本研究首先用 Western blot 及
的关键转录调节因子,调节脂肪从发育到代谢的基 Q⁃PCR明确了3T3⁃L1细胞分化过程中VPS13A的表
本进程,它对于脂肪细胞分化是必不可少的 ,但是 达变化,用 3T3⁃L1 细胞诱导分化为脂肪细胞,分别
[14]
PPARγ的生理配体仍旧未知。一般认为,脂肪组织的 收取不同分化天数的细胞检测 VPS13A 的表达水
增生是健康和适应性的,能够维持正常的代谢水平。 平,结果显示在细胞分化的第 2 天,VPS13A 的表达
总体而言,干预脂肪生成是肥胖的有效治疗措施。对 水平较第 0 天相比下调,上述研究结果显示脂肪细