Page 14 - 南京医科大学学报自然科学版
P. 14
第44卷第2期
·152 · 南 京 医 科 大 学 学 报 2024年2月
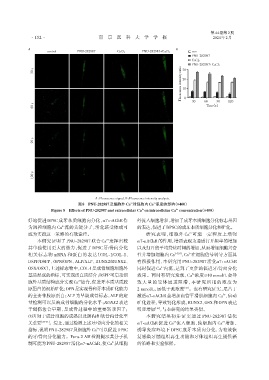
A B
control PNU⁃282987 CaCl2 PNU⁃282987+CaCl2 con
PNU⁃282987
CaCl2
PNU⁃282987+CaCl2
Fluoscence intensity ratio 20
30 s 30
10
90
60 s 0 30 60 Time(s) 120
90 s
s
120
A:Fluoscence signal. B:Fluoscence intensity analysis.
图8 PNU⁃282987及细胞外Ca 对细胞内Ca 浓度的影响(×400)
2+
2+
2+
2+
Figure 8 Effects of PNU⁃282987 and extracellular Ca on intracellular Ca concentration(×400)
好地促进DPSC成牙本质细胞向分化,α7⁃nAChR作 外流入细胞增多,增加了成牙本质细胞分化标志基因
为调控细胞内 Ca 流的关键分子,活化该受体或可 的表达,促进了DPSC的成牙本质细胞分化和矿化。
2+
成为实践这一策略的有效途径。 研究表明,细胞外 Ca 可能一定程度上增强
2+
本研究证明了 PNU⁃282987 联合 Ca 发挥出较 α7⁃nAChR的作用,增强表现为通道打开频率的增加
2+
其单独使用更大的潜力,促进了 DPSC 牙/骨向分化 以及打开的平均持续时间的增加,从而增加细胞兴奋
相关标志物 mRNA 和蛋白的表达(COL⁃I/COL⁃I、 性并增加细胞内Ca 2+[24] ,Ca 在细胞信号转导方面具
2+
DSPP/DSPP、OPN/OPN、ALP/ALP、RUNX2/RUNX2、 有积极作用,本研究用 PNU⁃282987 活化α7⁃nAChR
OSX/OSX),上述标志物中,COL⁃I是成骨细胞细胞外 同时促进Ca 内流,达到了更佳的促进牙/骨向分化
2+
基质形成的指标,可实现蛋白质结合;DSPP可启动细 效果。同时有研究发现,Ca 浓度≥10 mmol/L 会导
2+
胞外基质结构成分实现Ca 结合,促进牙本质基质胶 致大量的受体通道阻滞,本研究所用的浓度为
2+
原蛋白的初始矿化;OPN是实现骨和牙本质矿化能力 2 mmol/L,远低于此浓度 [25] 。也有研究证实,尼古丁
的主要非胶原蛋白;ALP为早期成骨标志,ALP的定 激活α7⁃nAChR会增加血管平滑肌细胞内 Ca ,启动
2+
量检测可以反映成骨细胞的分化水平;RUNX2表达 矿化进程,导致钙化形成,RUNX2、OSX和OPN表达
于创伤愈合早期,是成骨过程中的重要转录因子; 明显增加 ,与本研究的结果类似。
[16]
OSX对于成骨细胞的成熟以及膜内和软骨内骨化至 本研究结果初步证实通过 PNU⁃282987 活化
关重要 [22-23] 。综上,通过检测上述牙/骨向分化的相关 α7⁃nAChR 促进 Ca 流入细胞,使细胞内 Ca 增加,
2+
2+
2+
指标,说明PNU⁃282987及细胞外Ca 可以促进DPSC 诱导炎症环境下 DPSC 成牙本质向分化,为有效恢
的牙/骨向分化能力。Fura⁃2 AM检测提示其分子机 复感染牙髓组织再生功能和牙体组织再生提供新
制可能为PNU⁃282987活化α7⁃nAChR,使Ca 从细胞 的策略和实验依据。
2+