Page 11 - 南京医科大学学报自然科学版
P. 11
第41卷第7期 周小蓉,陆 霞,李建涛,等. 成年小鼠ECSIT 3′⁃UTR的鉴定及功能分析[J].
2021年7月 南京医科大学学报(自然科学版),2021,41(07):937-942 ·941 ·
A B
NC siRNA1 siRNA2 siRNA3 siRNA4 NC siRNA1 siRNA2 siRNA3 siRNA4
ECSIT 55 kDa ECSIT 55 kDa
GAPDH 37 kDa GAPDH 37 kDa
1.5 ** 1.5 *
** *
ECSIT 1.0 ECSIT 1.0
0.5 0.5
0 0
NC siRNA1 siRNA2 siRNA3 siRNA4 NC siRNA1 siRNA2 siRNA3 siRNA4
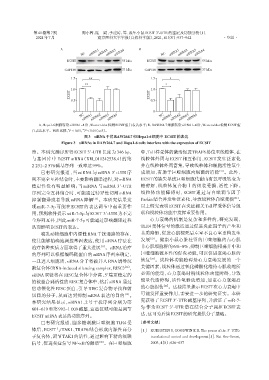
A:Hepa1⁃6细胞转染siRNA1~4后,Western blot检测ECSIT蛋白表达水平;B:RAW264.7细胞转染siRNA1~4后,Western blot检测ECSIT蛋
白表达水平。两组比较,P < 0.05,P < 0.01(n=3)。
*
**
图3 siRNA干扰RAW264.7和Hepa1⁃6细胞中 ECSIT的表达
Figure 3 siRNAs in RAW264.7 and Hepa1⁃6 cells interfere with the expression of ECSIT
难。本研究测序所得ECSIT 3′⁃UTR 长度为346 bp, 中,Toll样受体的激活促进TRAF6易位至线粒体,在
与基因库中 ECSIT mRNA(XM_011242538.4)的第 线粒体外周与 ECSIT 相互作用,ECSIT 发生泛素化
2 231~2 576碱基序列一致率达99%。 并在线粒体外周富集,导致线粒体和细胞活性氧生
已有研究报道,当 miRNA 与 mRNA 3′⁃UTR 序 成增加,有助于巨噬细胞内细菌的清除 [21] 。此外,
列不完全互补结合时,主要影响翻译过程,对mRNA ECSIT的缺失导致巨噬细胞代谢由有氧呼吸转变为
稳定性没有明显影响;当 miRNA 与 mRNA 3′⁃UTR 糖酵解,线粒体复合物Ⅰ的组装受损、活性下降。
序列完全互补结合时,可能通过特异性切割 mRNA 线粒体功能障碍时,ECSIT 通过与自噬调节因子
[22]
抑制翻译或者导致 mRNA 降解 [16] 。本研究结果发 Parkin结合并发生泛素化,导致线粒体自噬受损 。
现 miR⁃7⁃5p 可能在 ECSIT 的表达调节中起重要作 以上研究表明ECSIT在炎症相关Toll样受体信号级
用,预测软件提示miR⁃7⁃5p与ECSIT 3′⁃UTR为不完 联和线粒体功能中发挥重要作用。
全序列互补,因此miR⁃7⁃5p可能通过影响翻译过程 心力衰竭的机制是复杂和多样的,研究发现,
从而影响ECSIT的表达。 TLR4 受体信号的激活通过促进炎症因子的产生和
哺乳动物细胞中内源性RNA干扰通路的存在, 基质降解,促进心肌梗死后左室不良心室重构发生
使其能够精确地调控基因表达,使用 siRNA 疗法在 发展 [23] 。健康小鼠心脏驻留的巨噬细胞约占心肌
治疗各种疾病方面取得了重大进展 [17] 。siRNA治疗 非心肌细胞群的6%~8%,抑制巨噬细胞招募并中和
的序列可以根据编码靶蛋白的mRNA 序列来确定, 巨噬细胞破坏性的促炎功能,可以促进衰竭心脏的
一旦进入细胞质,siRNA 分子将被并入RNA 诱导沉 恢复 [24] 。线粒体功能障碍是心力衰竭发展的一个
[18]
默复合体(RNA⁃induced silencing complex,RISC) , 关键因素,线粒体通过氧化磷酸化维持心肌收缩所
siRNA 双链将在 RISC 复合体中分离,5′端更稳定的 必需的能量,心力衰竭时期线粒体功能障碍,导致
链被整合到活性的RISC复合体中,然后siRNA 通过 能量代谢障碍,活性氧释放增加,加重心力衰竭后
启动催化性 RISC 蛋白,引导 RISC 复合物寻找和剪 的心脏损伤 [25] 。这些结果提示ECSIT在心力衰竭中
切目的分子,从而达到抑制 mRNA 表达的目的 [19] 。 可能发挥重要作用,需要进一步的研究证实。本研
本研究结果显示,siRNA1、2 号干扰序列分别为第 究获得了ECSIT 3′⁃UTR碱基序列,并验证了miR⁃7⁃
5p 作为 ECSIT 3′⁃UTR 潜在结合分子调控 ECSIT 表
601~619和第992~1 009碱基,这些区域可能是调节
达,这可为后续ECSIT的研究提供分子基础。
ECSIT mRNA表达的功能序列。
已有研究报道,脂多糖刺激巨噬细胞 TLR4 受 [参考文献]
体后,ECSIT 与 TAK1、TRAF6 结合形成内源性高分 [1] KUERSTEN S,GOODWIN E B. The power of the 3′ UTR:
子复合体,调节TAK1的活性,通过影响下游的级联 translational control and development[J]. Nat Rev Genet,
信号,促进炎症信号NF⁃κB的激活 [20] 。在巨噬细胞 2003,4(8):626-637