Page 12 - 南京医科大学学报自然科学版
P. 12
第41卷第9期
·1278 · 南 京 医 科 大 学 学 报 2021年9月
A 250 * B 1 2 3 4 2.5
( pg/mL) 200 *# p⁃Smad3 52 kDa 2.0 * *#
1.5
150
Smad3
52 kDa
TGF⁃β1 100 p⁃Smad3/Smad3 1.0
0.5
50
0 0.0
1 2 3 4 1 2 3 4
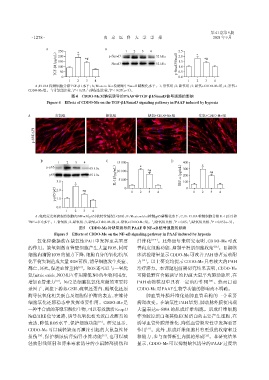
A:ELISA 检测细胞分泌TGF⁃β1水平;B:Western blot 检测细中Smad3磷酸化水平。1:常氧组;2:缺氧组;3:缺氧+CDDO⁃Me 组;4:常氧+
CDDO⁃Me组。与常氧组比较,P < 0.05;与缺氧组比较,P < 0.05(n=3)。
*
#
图4 CDDO⁃Me对缺氧诱导的PAAF中TGF⁃β1/Smad3信号通路的影响
Figure 4 Effects of CDDO⁃Me on the TGF⁃β1/Smad3 signaling pathway in PAAF induced by hypoxia
A 常氧组 缺氧组 缺氧+CDDO⁃Me组 常氧+CDDO⁃Me组
p⁃65/DAPI
B C D
1 2 3 4 15 000
( pg/mL) 10 000 *# *#
p⁃p65 * *
65 kDa ( pg/mL) 400
300
p65 65 kDa
3.0 IL⁃1β 5 000 TNF⁃α 200
100
* 0 0
p⁃p65/p65 2.0 *# 1 2 3 4 1 2 3 4
1.0
0.0
1 2 3 4
A:免疫荧光实验观察细胞内NF⁃κB(p65)核转位情况(×200);B:Western blot检测p65磷酸化水平;C、D:ELISA检测细胞分泌IL⁃1β(C)和
TNF⁃α(D)水平。1:常氧组;2:缺氧组;3:缺氧+CDDO⁃Me组;4:常氧+CDDO⁃Me组。与常氧组比较,P < 0.05;与缺氧组比较,P < 0.05(n=3)。
*
#
图5 CDDO⁃Me对缺氧诱导的PAAF中NF⁃κB信号通路的影响
Figure 5 Effects of CDDO⁃Me on the NF⁃κB signaling pathway in PAAF induced by hypoxia
氧化应激损伤在缺氧性 PAH 中发挥至关重要 纤维化 [8-9] 。此外近年来研究表明,CDDO⁃Me 可改
的作用。缺氧刺激血管壁细胞产生大量 ROS,同时 善内皮细胞功能、抑制平滑肌细胞收缩 [18] 。Ⅱ期临
细胞内清除ROS的能力下降,细胞自身的氧化/抗氧 床试验结果显示CDDO⁃Me可改善PAH患者运动耐
化平衡失调造成大量ROS蓄积,诱导细胞发生炎症、 力 [19] 。以上研究均提示 CDDO⁃Me 具有较大的 PAH
凋亡、坏死,促进血管重构 。ROS还可以与一氧化 治疗潜力。本课题组前期研究结果表明,CDDO⁃Me
[13]
氮(nitric oxide,NO)相互作用降低NO的生物利用度, 可降低野百合碱诱导的PAH大鼠平均肺动脉压,在
增加血管张力 。Nrf2是细胞抗氧化应激的重要转 PAH 动物模型中具有一定治疗作用 [20] 。然而目前
[14]
录因子,调控下游如GSH、硫氧还蛋白、醌氧化还原 CDDO⁃Me对PAAF生物学功能的影响尚不明确。
酶等抗氧化相关蛋白及细胞保护酶的表达,在维持 肺血管外膜纤维化是肺血管重构的一个重要
细胞氧化还原稳态中发挥重要作用。CDDO⁃Me 是 病理改变。在缺氧性PAH早期,肺动脉外膜便出现
一种半合成的齐墩果酸衍生物,可以有效激活Keap1/ 大量表达α⁃SMA 的肌成纤维细胞。肌成纤维细胞
Nrf2/ARE信号通路,诱导抗氧化相关蛋白及酶类的 作为胶原蛋白和其他ECM蛋白的主要产生细胞,在
表达,降低ROS水平,保护细胞功能 [15] 。研究显示, 诱导血管外膜纤维化、降低血管顺应性中发挥重要
CDDO⁃Me 可以减轻缺血再灌注引起的大鼠急性肾 作用 [21] 。此外,肌成纤维细胞具有更强的收缩和迁
损伤 [16] 、保护糖尿病肾病肾小管功能 [17] ,也可以减 移能力,参与血管新生内膜的形成 [22] 。本研究结果
轻放射线照射和博来霉素诱导的小鼠肺部损伤和 显示,CDDO⁃Me 可以抑制缺氧诱导的PAAF过度增