Page 11 - 南京医科大学学报自然科学版
P. 11
第42卷第6期 张洪都,王红顺,王天明,等. USP14调控OSBPL2蛋白去泛素化作用的实验研究[J].
2022年6月 南京医科大学学报(自然科学版),2022,42(06):759-767 ·763 ·
A HA HA⁃USP14 2.0 1.5 *
OSBPL2 mRNA 相对表达量 1.0 1.0
OSBPL2 56 kDa 1.5 ( /GAPDH)
GAPDH 37 kDa 0.5 OSBPL2蛋白表达相 0.5
0 对灰度值
HA HA⁃USP14 0
HA HA⁃USP14
B C
siRNA NC siUSP14 1.5
OSBPL2 mRNA 相对表达量 OSBPL2 55 kDa
OSBPL2 55 kDa 1.0 IU1(μmol/L) 0 50 100
USP14 56 kDa
GAPDH 37 kDa 0.5 USP14 56 kDa
0
NC siUSP14
GAPDH 37 kDa
D
OSBPL2蛋白表达相
HA HA⁃USP14 2.0 ** HA
0 h 2 h 4 h 8 h 0 h 2 h 4 h 8 h ( /GAPDH) 1.5 ** HA⁃USP14
OSBPL2 55 kDa **
37 kDa 0.5 *
GAPDH 对灰度值 1.0
0
0 h 2 h 4 h 8 h
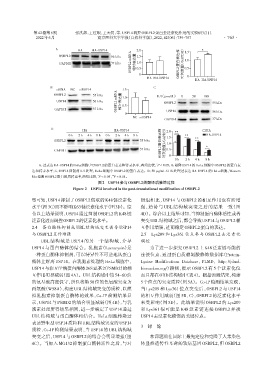
A:过表达HA⁃USP14的HeLa细胞中OSBPL2的蛋白表达和转录水平,两组比较,P<0.05;B:敲降USP14的HeLa细胞中OSBPL2的蛋白表
*
达和转录水平;C:USP14 抑制剂 IU1 处理,HeLa 细胞中 OSBPL2 的蛋白表达。D:50 μg/mL CHX 处理过表达 HA⁃USP14 的 HeLa 细胞,Western
blot检测OSBPL2蛋白的周转速率,两组比较,P<0.05,P<0.01。
**
*
图2 USP14参与OSBPL2的翻译后修饰过程
Figure 2 USP14 involved in the post⁃translational modification of OSBPL2
型可知,USP14抑制了OSBPL2偶联的K48链泛素化 照组相比,USP14 与 OSBPL2 的相互作用也有所增
水平(图3C)而不影响K63链泛素化水平(图3D)。综 强,趋势与 UBL 结构域突变之后的结果一致(图
合以上结果说明,USP14通过抑制OSBPL2的K48链 4D)。综合以上结果可知,当抑制蛋白酶体活性或者
泛素化进而调控OSBPL2的泛素化水平。 突变UBL结构域之后,都会导致USP14与OSBPL2相
2.4 蛋白酶体抑制或 UBL 结构域突变诱导 USP14 互作用增强,进而稳定OSBPL2蛋白的表达。
与OSBPL2互作增强 2.5 Lys209 和 Lys361 位点参与 OSBPL2 去泛素化
UBL 结构域是 USP14 的另一个结构域,介导 调控
USP14 与蛋白酶体的结合。乳胞素(Lactacysin)是 为了进一步探究 OSBPL2 上 K48 泛素链可能的
一种蛋白酶体抑制剂,可以特异性不可逆地从蛋白 连接位点,通过蛋白质赖氨酸修饰数据库(Protein⁃
酶体上解离USP14。在乳胞素处理的HeLa细胞中, Lysine Modifications Database,PLMD,http://plmd.
USP14与非ATP酶蛋白酶体26S亚基2(PSMD2)的相 biocuckoo.org/)预测,提示 OSBPL2 有 5 个泛素化位
互作用明显减弱(图4A)。UBL结构域中第54~60位 点且都在ORD结构域中(表4)。根据预测结果,构建
的氨基酸高度保守,所以将第58位的色氨酸突变为 5个位点的突变质粒(图5A)。Co⁃IP检测结果发现,
丙氨酸(W58A),构建UBL结构域突变的质粒,以模 当 Lys209 和 Lys361 位点突变后,OSBPL2 与 USP14
拟乳胞素抑制蛋白酶体的效果,Co⁃IP 检测结果显 的相互作用减弱(图 5B、C),OSBPL2 的泛素化水平
示,USP14 与 PSMD2 的结合明显减弱(图 4B),与乳 未受影响(图 5D)。此结果说明 OSBPL2 的 Lys209
胞素处理所得结果相同,进一步确定了USP14通过 和 Lys361 很可能是 K48 泛素链连接 OSBPL2 并被
UBL 结构域与蛋白酶体相结合。HeLa 细胞转染过 USP14去泛素化修饰的关键位点。
表达野生型USP14质粒和UBL结构域突变的USP14 3 讨 论
质粒,Co⁃IP 检测结果表明,当 USP14 的 UBL 结构域
突变之后,USP14 与 OSBPL2 的结合会明显增强(图 本课题组在国际上最先定位和克隆了人常染色
4C)。当加入 MG132 抑制蛋白酶体活性之后,与对 体显性遗传性耳聋的致病基因 OSBPL2,但 OSBPL2