Page 13 - 南京医科大学学报自然科学版
P. 13
第42卷第6期 张洪都,王红顺,王天明,等. USP14调控OSBPL2蛋白去泛素化作用的实验研究[J].
2022年6月 南京医科大学学报(自然科学版),2022,42(06):759-767 ·765 ·
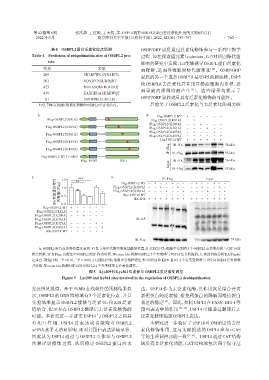
表4 OSBPL2蛋白泛素化位点预测 OSBP/ORP成员通过泛素化修饰参与一系列生物学
Table 4 Prediction of ubiquitination sites of OSBPL2 pro⁃ 过程,如在探索镉元素(cadmium,Cd)对胆固醇代谢
tein
影响的研究中发现,Cd能够诱导OSBPL蛋白泛素化
位点 多肽 而降解,进而导致胆固醇代谢紊乱 [20] 。OSBP/ORP
209 PKLKFWGKVEAEPR
家族的另一个成员OSBPL8是USP5的新底物,USP5
361 VQVIPGSKLWRINT
使 OSBPL8 去泛素化并在结直肠癌细胞内累积,进
423 MDLASQEKRLEEKQ
而导致内质网应激产生 [21] 。这些结果均提示了
439 EARRERAKEAEWQT
OSBP/ORP家族成员具有泛素化修饰的可能性。
081 FSVWTILKCVGLEL
红色字体为PLMD数据库预测的OSBPL2泛素化位点。 目前关于OSBPL2泛素化与去泛素化的相关研
A B Flag⁃OSBPL2 WT + - - - - -
Flag⁃OSBPL2(K81A) Flag⁃OSBPL2(K81A) - + - - - -
Flag⁃OSBPL2(K209A) - - + - - -
Flag⁃OSBPL2(K209A) Flag⁃OSBPL2(K361A) - - - + - -
Flag⁃OSBPL2(K423A) - - - - + -
Flag⁃OSBPL2(K361A)
Flag⁃OSBPL2(K439A) - - - - - +
Flag⁃OSBPL2(K423A) HA⁃USP14 WT + + + + + +
Flag IB:HA 56 kDa
Flag⁃OSBPL2(K439A)
IP: IB:Flag 55 kDa
Flag⁃OSBPL2 WT(1-480)
Flag FFAT ORD IB:HA 56 kDa
Input
IB:Flag 55 kDa
C ** *** D Flag⁃OSBPL2 WT - + - IP:Flag + - - - + - Input + - -
HA标签蛋白相对 ( /Flag) 1.5 Flag⁃OSBPL2(K209A) - - + - - + - - + - - - + - + + + - + -
-
-
1.0
Flag⁃OSBPL2(K361A) -
- - -
+
- -
- -
+
+
-
灰度值
Myc⁃USP14 WT -
+ +
-
- - -
+
+
+
+ +
0.5
+ +
+
+
+
HA⁃K48 +
+ +
+ + +
+
0.0
Flag⁃OSBPL2 WT + - - - - -
Flag⁃OSBPL2(K81A) - + - - - -
Flag⁃OSBPL2(K209A) - - + - - -
Flag⁃OSBPL2(K361A) - - - + - - IB:HA
Flag⁃OSBPL2(K423A) - - - - + -
Flag⁃OSBPL2(K439A) - - - - - +
HA⁃USP14 WT + + + + + +
IB:Flag 55 kDa
A:OSBPL2蛋白点突变位置示意图,红色五角星代表突变氨基酸的位置;B:HEK293Ta细胞中分别将5个OSBPL2点突变质粒与USP14质
粒共转染,IP为Flag,以野生型OSBPL2的IP 作为对照,Western blot检测OSBPL2 5个突变体与USP14结合的强弱;C:灰度扫描分析HA∕Flag标
记蛋白,两组比较,P < 0.01, P < 0.001;D:HEK293Ta细胞中分别将野生型OSBPL2和K209、K361 2个点突变质粒与USP14和K48泛素质粒
***
**
共转染,Western blot检测USP14对OSBPL2 2个突变体的去泛素化调控。
图5 Lys209和Lys361位点参与OSBPL2去泛素化调控
Figure 5 Lys209 and lys361 sites involved in the regulation of OSBPL2 deubiquitination
究还鲜见报道。基于PLMD在线软件的预测结果提 达。USP14 作为去泛素化酶,其作用就是结合并切
示,OSBPL2的ORD 结构域有5个泛素化位点,并且 割靶蛋白的泛素链,避免靶蛋白的降解而维持蛋白
实验结果显示 OSBPL2 能够与泛素 Ub 和 K48 泛素 表达的稳定 [22] 。因此,如同USP14在FASN、RIG⁃I等
链结合,提示存在 OSBPL2 翻译后去泛素化修饰的 蛋白表达中的作用 [23-24] ,USP14 可能通过翻译后去
可能。本研究进一步证实USP14与OSBPL2之间具 泛素化修饰稳定OSBPL2表达。
有 相互作用,USP14 过表达或者敲降对 OSBPL2 本研究进一步验证了USP14对OSBPL2的去泛
mRNA水平无明显影响,而对其蛋白表达影响显著, 素化修饰作用,这与文献报道的 USP14 参与 cGAS
因此认为 USP14 通过与 OSBPL2 互作参与 OSBPL2 等的生理调控功能一致 [25-26] 。USP14通过CAT结构
的翻译后修饰过程,从而稳定 OSBPL2 蛋白的表 域发挥去泛素化功能,CAT 结构域包含两个保守基