Page 44 - 南京医科大学学报自然科学版
P. 44
第43卷第1期
· 38 · 南 京 医 科 大 学 学 报 2023年1月
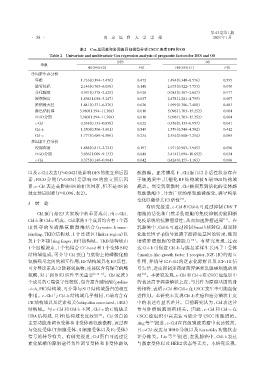
表2 Cox单因素和多因素回归模型分析CSCC患者DFS和OS
Table 2 Univariate and multivariate Cox regression analysis of prognostic factors for DFS and OS
DFS OS
参数
HR(95% CI) P值 HR(95% CI) P值
单因素生存分析
年龄 1.716(0.394~7.470) 0.472 1.494(0.340~6.576) 0.595
脉管侵犯 2.146(0.763~6.038) 0.148 2.673(0.922~7.753) 0.070
分化程度 0.957(0.378~2.425) 0.926 0.985(0.367~2.647) 0.977
浸润深度 1.836(1.038~3.247) 0.037 2.478(1.281~4.795) 0.007
肿瘤最大径 1.441(0.331~6.270) 0.626 1.699(0.386~7.480) 0.483
淋巴结转移 3.980(1.394~11.368) 0.010 5.096(1.703~15.252) 0.004
FIGO分期 3.980(1.394~11.368) 0.010 5.096(1.703~15.252) 0.004
c⁃Cbl 0.338(0.133~0.856) 0.022 0.356(0.133~0.957) 0.041
Cbl⁃b 1.350(0.506~3.601) 0.549 1.559(0.540~4.502) 0.412
Cbl⁃c 1.777(0.689~4.586) 0.234 2.534(0.880~7.294) 0.085
多因素生存分析
浸润深度 1.488(0.813~2.721) 0.197 1.971(0.983~3.949) 0.056
FIGO分期 3.036(1.009~9.133) 0.048 3.414(1.094~10.652) 0.034
c⁃Cbl 0.375(0.146~0.964) 0.042 0.424(0.155~1.163) 0.096
以及c⁃Cbl表达(P=0.042)是影响DFS的独立预后因 酸激酶。正常情况下,Cbl 蛋白以非活性状态存在
素;FIGO 分期(P=0.034)是影响 OS 的独立预后因 于细胞质中,其催化 RF 结构域被 N 端 TKB 结构域
素;c⁃Cbl 表达是影响 OS 的相关因素,但不是 OS 的 掩盖。当受到刺激时,Cbl 被招募到活化的受体酪
独立预后因素(P=0.096,表2)。 氨酸激酶中,导致广泛的酪氨酸磷酸化,诱导构象
[12]
变化以激活其E3活性 。
3 讨 论
+
有研究报道,c⁃Cbl 和 Cbl⁃b 可通过抑制 CD8 T
Cbl 蛋白是 E3 大家族中的重要成员,由 c⁃Cbl、 细胞的活化和自然杀伤细胞的免疫抑制功能阻断
Cbl⁃b和Cbl⁃c组成。Cbl家族3个成员均含有1个高 免疫系统的抗肿瘤活性,从而加速肿瘤进展 [13] 。在
度 保 守 的 N 端 酪 氨 酸 激 酶 结 合(tyrosine kinase⁃ 乳腺癌中,Cbl⁃b 可通过抑制 Smad3 核转位,抑制转
binding,TKB)结构域、1 个连接区(linker region)以 化生长因子⁃β信号通路下游抑癌基因的转录,继而
及 1 个环指(ring finger,RF)结构域。TKB 结构域由 增强肿瘤细胞的侵袭能力 [14] 。有研究发现,过表
1 个四螺旋束、1 个钙结合 EF⁃hand 和 1 个变体 SH2 达 Cbl⁃b 可促进 Cbl⁃b 与胰岛素样生长因子 1 受体
结构域组成,可介导 Cbl 蛋白与底物上的磷酸化酪 (insulin⁃like growth factor 1 receptor,IGF⁃1R)的相互
氨酸残基之间的相互作用;RF结构域具有E3活性, 作用,并诱导 IGF⁃1R 的泛素化降解以及 IGF⁃1R 信
可介导泛素从E2转移到底物;连接区含有保守的酪 号失活,进而抑制多药耐药胃癌和乳腺癌细胞的增
氨酸,对于调节 E3 活性至关重要 [6,10-11] 。Cbl 家族 3 殖 [15] 。本研究发现,c⁃Cbl和Cbl⁃c在CSCC癌组织中
个成员的C端保守性较低,包含富含脯氨酸(proline 的表达高于癌旁鳞状上皮,与其作为原癌基因的身
⁃rich,PR)结构域,可介导与SH3结构域蛋白的相互 份相符,表明c⁃Cbl和Cbl⁃c在CSCC发生中可能起促
作用。c⁃Cbl 与 Cbl⁃b 结构域几乎相同,C 端均含有 进作用。本研究未发现Cbl⁃b在癌和癌旁鳞状上皮
PR结构域以及泛素相关(ubiquitin associated,UBA) 中的表达有显著差异。目前研究认为,Cbl 表达异
结构域。与 c⁃Cbl 和 Cbl⁃b 不同,Cbl⁃c 的 C 端缺乏 常与肿瘤细胞增殖相关。因此,c⁃Cbl 和 Cbl⁃c 在
UBA 结构域,且 PR 结构域长度较短 。Cbl 蛋白的 CSCC 癌组织中高表达可能介导 CSCC 细胞增殖。
[5]
主要功能是调节受体和非受体酪氨酸激酶,该过程 Jing 等 [16] 报道,c⁃Cbl 在高级别胶质瘤中表达较高,
与免疫受体(T 细胞受体、B 细胞受体以及 Fc 受体) 且 c⁃Cbl 表达与 WHO 分级以及 Karnofsky 功能状态
信号的转导有关。有研究报道,Cbl 蛋白可通过泛 评分相关。Liu 等 [17] 报道,在乳腺癌中,Cbl⁃b 表达
素化依赖的降解途径负性调节受体和非受体酪氨 与激素受体以及 HER2 状态等无关。本研究发现,