Page 33 - 南京医科大学学报自然科学版
P. 33
第43卷第2期 朱伯谦,宋兵战,陈 凯,等. DNA甲基化调控p16表达在替格瑞洛改善血管内皮功能中的
2023年2月 作用及机制[J]. 南京医科大学学报(自然科学版),2023,43(2):169-178 ·175 ·
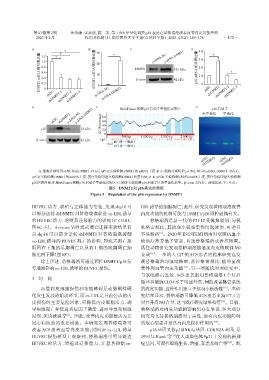
A B C D
* 30 * pcDNA⁃NC pcDNA⁃DNMT1 4.0 *
mRNA相对表达量 1.0 mRNA相对表达量 20 DNMT1 183 kDa mRNA相对表达量 3.0 *
*
1.2
*
0.8
2.0
0.6
10
1.0
DNMT1 0.4 0 DNMT1 0 β⁃actin 42 kDa p16 0 shHC
0.2
shDNMT1⁃2
pcDNA⁃DNMT1
shHC shDNMT1⁃2 pcDNA⁃NC shDNMT1 shDNMT1⁃3
shDNMT1⁃1
shDNMT1⁃3
E F MethPrimer预测p16启动子甲基化富集区 G 未甲基化 甲基化
p16启动子
pcDNA⁃DNMT1
shNC shDNMT1 pcDNA⁃NC GC Percentage 80
60
p16 18 kDa 40
20
0
0 500 bp 1 000 bp 1 500 bp 2 000 bp
β⁃actin 42 kDa CpG
MF1 HR1
Set1
UF1 UR1
shNC shNC
shDNMT1
shDNMT1
A:细胞分别转染shNC和shDNMT1,48 h后qPCR实验检测DNMT1的mRNA丰度;B、C:细胞分别转染pcDNA⁃NC和pcDNA⁃DNMT1,48 h后,
qPCR实验检测DNMT1的mRNA丰度,蛋白免疫印迹实验检测DNMT1的蛋白量;D、E:qPCR实验检测p16的mRNA丰度,蛋白免疫印迹实验检测
p16的蛋白量;F:MethPrimer预测p16 启动子甲基化富集区;G:MSP实验检测p16启动子区的甲基化水平。β⁃actin为内参。两组比较,P < 0.01。
*
图5 DNMT1对p16表达的调控
Figure 5 Regulation of the p16 expression by DNMT1
HUVEC 活力、增殖与迁移能力变化,发现 shp16 可 LDL诱导的细胞凋亡;此外,研究发现替格瑞洛改善
以部分逆转shDNMT1对替格瑞洛促进ox⁃LDL 诱导 内皮功能的机制可能与DNMT1/p16调控通路有关。
的 HUVEC 活力、增殖及迁移能力的影响(P < 0.01, 替格瑞洛是新一代的 P2Y12 受体抑制剂,与氯
图 6C~E)。Annexin V/PI 流式凋亡迁移实验结果显 吡格雷相比,其抗血小板聚集作用起效快、可逆且
[9]
示 shp16 可以部分逆转 shDNMT1 对替格瑞洛抑制 不易耐药 。2020年ESCSTEMI指南对双联抗血小
ox⁃LDL 诱导的 HUVEC 凋亡的影响,即流式凋亡象 板治疗推荐做了更新,首选替格瑞洛或普拉格雷。
限图右下角的早期凋亡以及右上角的晚期凋亡细 既往动物研究发现替格瑞洛能增加内皮依赖性NO
胞比例下降(图6F)。 合成 [10] ;一项纳入 127 例 ACS 患者的临床研究也发
综上所述,替格瑞洛可通过调控DNMT1/p16信 现替格瑞洛与氯吡格雷、普拉格雷相比,能明显改
号通路影响ox⁃LDL诱导的HUVEC损伤。 善外周血管内皮功能 [11] ;另一项随机对照研究中,
与氯吡格雷比较,ACS 患者服用替格瑞洛 1 个月后
3 讨 论
循环祖细胞CD34水平明显升高,间接改善脉管系统
血管内皮细胞损伤和功能障碍是动脉粥样硬 的内皮功能,这种作用独立于抗血小板活性 。本研
[12]
化发生发展的始动环节,而ox⁃LDL是目前公认的内 究结果显示,替格瑞洛可降低ACS患者血清ET⁃1含
皮损伤的主要危险因素,可降低内皮细胞活力、诱 量并升高NO含量,这与既往研究结果相符 。目前,
[13]
导细胞凋亡并促进炎症因子激活,进而导致炎细胞 替格瑞洛对内皮功能的影响仍存在争议,但大部分
[8]
浸润、斑块破裂等 。因此,改善内皮功能被认为是 研究均支持替格瑞洛对于高危、原有内皮功能障碍
[14]
冠心病防治的重要措施。本研究发现替格瑞洛可 的冠心病患者是具有内皮保护作用的 。
改善 ACS 患者血管内皮功能;同时在 ox⁃LDL 诱导 p16基因又称p16INK4a基因、CDKN2A基因,是
[15]
HUVEC 损伤模型上观察到,替格瑞洛可明显促进 1994 年Kamb等 在人类染色体9p21上发现的新抑
[16]
HUVEC 的活力、增殖及迁移能力,并显著抑制 ox⁃ 癌基因,可调控细胞生长、增殖、衰老及凋亡等 。既