Page 12 - 南京医科大学自然版
P. 12
第44卷第10期
·1328 · 南 京 医 科 大 学 学 报 2024年10月
A B
100 * *** * * *
% S100A4 positive cells 60
80
40
20
0
5 000 μm
Positive lymph node
Metastasis
Pancreatitis
Normal Adjacent tissue Negative lymph node
Primary tumor
C D
*** *** *
* *** * * *** ***
150 150
** ***
H⁃Score 100 H⁃N⁃Score 100
50 50
0 0
Primary tumor
Pancreatitis
Metastasis
Positive lymph node
Metastasis
Pancreatitis
Positive lymph node
Primary tumor
Normal Adjacent tissue Negative lymph node Normal Adjacent tissue Negative lymph node
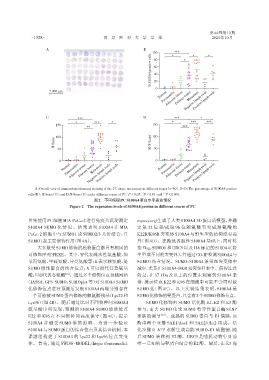
A:Overall view of immunohistochemical staining of the PC tissue microarray in different stages(n=60). B-D:The percentage of S100A4 positive
**
*
cells(B),H⁃Score(C),and H⁃N⁃Score(D)under different course of PC. P < 0.05,P < 0.01,and *** P < 0.001.
图2 不同病程PC S100A4蛋白水平表达情况
Figure 2 The expression levels of S100A4 protein in different course of PC
首先使用PC细胞MIA PaCa⁃2进行免疫共沉淀测定 expasy.org/生成了人类S100A4 3D蛋白质模型,并确
S100A4 SUMO 化情况。结果表明 S100A4 在 MIA 定第 22 位和/或第 96 位赖氨酸突变成精氨酸的
PaCa⁃2 细胞中与 SUMO1 或 SUMO2/3 共价结合,且 K22R/K96R 突变体 S100A4 与野生型的结构没有差
SUMO1起主要修饰作用(图4A)。 异(图 4D)。在敲低内源性 S100A4 基础上,同时转
大多数受SUMO修饰的底物蛋白都具有相同的 染 Flag⁃SUMO1 和 UBC9 以及 HA 标记的 S100A4(野
可修饰序列ΨKXE。其中,Ψ代表疏水性氨基酸,如 生型或不同的突变体),并通过CO⁃IP检测S100A4与
苯丙氨酸、甲硫氨酸、异亮氨酸等;K表示赖氨酸,是 SUMO1 结合情况。SUMO⁃S100A4 条带在突变体中
SUMO 修饰蛋白的结合位点;X 可以指代任意氨基 减少,尤其在S100A4⁃DKR双突变样本中。值得注意
[15]
酸;E则代表谷氨酸 。通过多个修饰位点预测网站 的是,在 37 kDa 及以上的位置未观察到 S100A4 条
(JASSA、GPS⁃SUMO、SUMOplot 等)对S100A4 SUMO 带,提示位点 K22 和 K96 在细胞中可能不会同时被
化修饰位点进行预测后发现 S100A4 两端分别存在 SUMO 化(图 4E)。以上实验结果表明,S100A4 是
一个可能被SUMO蛋白修饰的赖氨酸残基(Lys22和 SUMO化修饰的靶蛋白,且含有2个SUMO修饰位点。
Lys96)(图 4B)。随后通过比对不同物种间 S100A4 SUMO化修饰由 SUMO 活化酶 E1、E2 和 E3 酶
氨基酸序列发现,预测的 S100A4 SUMO 修饰位点 参与,而去 SUMO 化受 SUMO 特异性蛋白酶 SENP
K22 和 K96 在不同物种间高度保守(图 4C),提示 家族的调节 [16] 。成熟的 SUMO 蛋白与 E1 偶联,该
S100A4 普遍受 SUMO 修饰影响。为进一步验证 酶由两个亚基 SAE1/Aos1 和 SAE2/Uba2 组成。活
S100A4与SUMO蛋白的结合位点及其结合机制,本 化步骤由 ATP 水解生成高能 SUMO⁃E1 硫酯键,随
课题组构建了 S100A4 的 Lys22 和 Lys96 位点突变 后 SUMO 转移到 E2 酶。UBC9 是哺乳动物中目前
体。首先,通过 SWISS⁃MODEL(https://swissmodel. 唯一已知的与靶蛋白结合的E2酶。最后,在 E3 连