Page 34 - 南京医科大学学报自然科学版
P. 34
第42卷第1期
· 28 · 南 京 医 科 大 学 学 报 阴性对照组 2022年1月
5
Caspase抑制剂+H2O2组
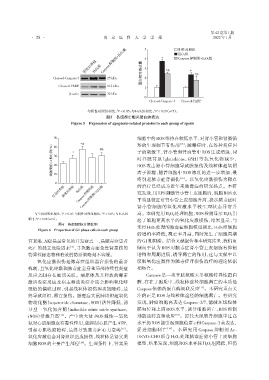
阴性对照组 H2O2组 Caspase抑制剂+H2O2组 4 3 * *& H2O2组 *
Cleaved⁃Caspase 3 25 kDa 蛋白相对表达量 2 *&
Cleaved⁃PARP 112 kDa
1
β⁃actin 32 kDa
0
Cleaved⁃Caspase 3 Cleaved⁃PARP
与阴性对照组相比,P < 0.05;与H2O2组相比,P < 0.05(n=5)。
&
*
图5 各组凋亡相关蛋白的表达
Figure 5 Expression of apoptosis⁃related proteins in each group of spesis
50 细胞中的ROS维持在较低水平,对肾小管和肾微循
( % ) 40 * *& #& 环的生理调节有作用 [15] ;脓毒症时,在各种炎症因
子的刺激下,肾小管和肾血管中 ROS 生成增强,同
细胞周期G1期比例 30 时谷胱甘肽(glutathione,GSH)等抗氧化物减少,
ROS 攻击肾小管细胞导致膜损伤及线粒体超氧阴
20
离子渗漏,随着细胞中 ROS 浓度的进一步增加,最
10
终引起脓毒症肾损伤 [16] 。以氧化应激损伤为靶点
0 的治疗已经成为近年来脓毒症的研究热点。本研
空白对照组 阴性对照组 H2O2组 Caspase抑制剂+H2O2组 究发现,用LPS刺激肾小管上皮细胞后,细胞ROS水
Caspase抑制剂组
平明显较正常肾小管上皮细胞升高,提示脓毒症时
高。本研究用H2O2处理细胞,ROS检测显示H2O2引
与空白对照组相比,P < 0.05;与阴性对照组相比,P < 0.05;与H2O2组 肾小管细胞的氧化应激水平较生理状态异常升
&
*
相比,P < 0.05(n=5)。 起了细胞更高水平的氧化应激损伤,结果显示,与
#
图6 各组细胞G1期比例 未经H2O2处理的脓毒症细胞模型相比,H2O2组细胞
Figure 6 Proportion of G1 phase cells in each group
的增殖率降低,凋亡率升高,同时发生了细胞周期
官衰竭,AKI是最常见的并发症之一,是脓毒症患者 的G1期阻滞。结合文献报告和本研究结果,我们更
死亡的独立危险因素 ,寻找脓毒症急性肾损伤的 倾向于认为 ROS 对脓毒症肾小管上皮细胞有抑制
[2]
特异性标志物和有效的防治策略刻不容缓。 增殖和周期进展,诱导凋亡的作用,这与文献中以
氧化应激损伤是脓毒症组织器官损伤的重要 缓解氧化应激作为脓毒症肾损伤治疗的理论依据
机制,且氧化应激和脓毒症全身和局部持续性炎症 相吻合。
反应之间存在密切关联。病原体及其释放的毒素 Caspase 是一类半胱氨酸天冬氨酸特异性蛋白
激活炎症反应及宿主释放炎症介质会影响氧化呼 酶,存在于胞质中,线粒体途径细胞凋亡的本质是
吸链的偶联过程,引起线粒体损伤和功能障碍,最 Caspase 依赖的蛋白酶级联反应 [17] 。本研究重点关
终导致组织、器官损伤。脓毒症大鼠肺组织超氧化 注的正是 ROS 与线粒体途径的细胞凋亡。有研究
物歧化酶(superoxide dismutase,SOD)活性降低,诱 发现,肿瘤细胞高表达 Caspase⁃3/7,能破坏线粒体
导型一氧化氮合酶(inducible nitric oxide synthase, 膜电位和上调 ROS 水平,诱导细胞凋亡,ROS 抑制
iNOS)活性升高 [12] 。产生的大量 iNOS 源性一氧化 剂能逆转这种效应 [18] 。原代大鼠软骨细胞中过高
氮对心肌细胞也有毒性作用,能抑制心肌产生ATP, 水平的ROS能引起细胞色素c和Caspase⁃3高表达,
引起心肌收缩障碍,最终导致脓毒症心力衰竭 [13] 。 促进细胞凋亡 [19] 。本研究用 Caspase 抑制剂 Ac⁃
氧化应激也会对肾组织造成损伤,线粒体是肾实质 DEVD⁃CHO 联合 H2O2处理脓毒症肾小管上皮细胞
细胞ROS的主要产生部位 [14] 。生理条件下,肾实质 模型,结果发现,细胞ROS水平较H2O2组降低,但仍