Page 41 - 南京医科大学学报自然科学版
P. 41
第42卷第2期 韩 晟,周锦仁,邵 青,等. MCT1在预测肝细胞癌患者预后中的作用研究[J].
2022年2月 南京医科大学学报(自然科学版),2022,42(02):184-188,210 ·187 ·
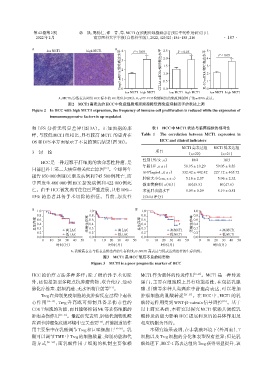
A B
2 相对表达水平 3 mRNA相对表达水平 2.0 mRNA相对表达水平 4 3
low MCT1 high MCT1 4 P<0.05 2.5 P<0.05 5 P<0.05
1.5
1 mRNA 1.0 2
0 Foxp3 CTLA4 0.5 1 0 IL⁃10
0.0
low MCT1 high MCT1 low MCT1 high MCT1 low MCT1 high MCT1
A:MCT1高/低表达两组HCC标本的HE染色(×200);B:qRT⁃PCR检测两组的免疫抑制因子的mRNA表达。
图2 MCT1高表达的HCC中免疫细胞增殖频率降低而免疫抑制因子的表达上调
Figure 2 In HCC with high MCT1 expression,the frequency of immune cell proliferation is reduced while the expression of
immunosuppressive factors is up⁃regulated
和 DFS 分析无明显差异(图 3A)。正如预期的那 表1 HCC中MCT1表达与临床指标的相冯性
样,与较低MCT1组相比,具有较高 MCT1 的患者在 Table 1 The correlation between MCT1 expression in
OS和DFS率方面显示了不良的预后结果(图3B)。 HCC and clinical indicators
MCT1高表达组 MCT1低表达组
3 讨 论 项目 (n=22) (n=21)
性别(男/女,n) 18/4 18/3
HCC是一种起源于肝细胞的致命恶性肿瘤,是
年龄(岁,x ± s) 58.95 ± 10.29 59.05 ± 8.830
目前世界上第二大癌症相关死亡原因 [12] 。全球每年
AFP(ng/mL,x ± s) 332.42 ± 442.42 227.12 ± 465.72
报告850 000例HCC新发病例和745 500例死亡,而
肿瘤大小(cm,x ± s) 5.16 ± 2.37 5.96 ± 2.32
中国发生 466 000 例 HCC 新发病例和 422 000 例死 微血管癌栓[n(%)] 10(45.5) 10(47.6)
亡。由于 HCC被发现时往往已严重进展,只有10%~ 术前肝功能水平 5.09 ± 0.29 5.19 ± 0.51
15% 的患者具备手术切除的指征。目前,原发性 (Child评分)
A B
1.0 1.0 1.0 1.0
0.8
0.8
总生存率 0.8 无病生存率 0.6 总生存率 0.8 * 无病生存率 0.6 *
0.6
0.6
0.4
0.4
0.4
0.4
0.3
0.2
0.2 高LAC 0.3 高LAC 0.3 高MCT1 0.3 高MCT1
0.2
0.2
低LAC 低LAC 低MCT1 低MCT1
0.0 0.0 0.0 0.0
0 10 20 30 40 50 0 10 20 30 40 50 0 10 20 30 40 50 0 10 20 30 40 50
时间(月) 时间(月) 时间(月) 时间(月)
A:乳酸高表达与低表达组患者的生存曲线;B:MCT1高表达与低表达组患者的生存曲线。
图3 MCT1 是HCC预后不良的标志物
Figure 3 MCT1 is a poor prognostic marker of HCC
HCC 的治疗方法多种多样;除了根治性手术切除 MCT1作为载体的转运作用 [6,24] 。MCT1是一种转运
外,还包括新型多靶点抗肿瘤药物、联合化疗、经动 蛋白,主要在细胞膜上具有功能活性,在包括乳腺
[13]
脉化疗栓塞、射频消融、无水酒精注射等 。 癌、肝癌等多种人类癌症中普遍高表达,可以增加
Treg在抑制免疫细胞的抗肿瘤反应过程中起核 肿瘤细胞的乳酸转运 [25-27] 。在 HCC 中,MCT1 的乳
心作用 [14- 15] ,Treg 升高既可抑制具备杀伤毒性的 酸转运作用受到WNT⁃β⁃catenin 信号调控 [25] 。基于
CD8 T细胞的功能,而且能够抑制NK等杀伤细胞的 以上研究基础,本研究以探究 MCT1 依赖其调控乳
肿瘤杀伤作用 [16-17] 。最近研究表明,肿瘤代谢物乳酸 酸转运的能力影响 HCC 进展和预后的具体作用及
在调节肿瘤免疫微环境中至关重要 ,目前报道的作 相应机制为目的。
[18]
用主要集中在乳酸调节Treg和巨噬细胞上 [19-20] 。乳 本研究结果表明,在非乳酸环境下(外周血),T
酸可以调节TME中Treg的细胞数量、抑制功能和代 细胞以及Treg细胞的分化和表型没有差异;但是乳
谢方式 [21- 23] ;而乳酸作用于细胞的机制主要依赖 酸处理下,MCT⁃1高表达组的Treg获得明显提升,该